Современный взгляд на проблему боли в позвоночнике
794
Маркин С.П.
Боль – важнейший физиологический механизм защиты организма от различных неблагоприятных воздействий. Международная ассоциация по изучению боли определяет ее, как неприятное сенсорное и эмоциональное состояние, обусловленное действительным или возможным повреждающим воздействием на ткани. По данным литературы, около 90% всех заболеваний связано с болью. При этом от 7 до 64% населения периодически испытывают чувство боли, а от 7,6 до 45% страдают рецидивирующей или хронической болью.
С позиции патофизиологии принято различать ноцицептивную и нейропатическую боль. Ноцицеп¬тив¬ной называют боль, которая обусловлена воздействием какого–либо фактора (травма, ожог, воспаление и т.д.) на периферические болевые рецепторы (ноцицепторы) при интактности всех отделов нервной системы. Ноцицептивные боли чаще являются острыми и достаточно быстро регрессируют после лечения анальгетиками. Под нейропатической подразумевают боль, возникающую при органическом поражении или нарушении функции различных отделов нервной системы (периферической или центральной). Нейропатические боли преимущественно хронические и, как правило, не купируются приемом обычных анальгетиков.
Классическим примером ноцицептивной боли являются болевые синдромы, обусловленные остеохондрозом позвоночника. Хотя при прогрессировании патологического процесса с развитием компрессионного синдрома (в частности, при радикулопатии) имеет место сочетание ноцицептивного и нейропатического компонентов боли (так, нейропатический компонент встречается с частотой от 33 до 55% случаев).
Остеохондроз – это дегенеративный процесс в межпозвонковых дисках с последующим вовлечением тел смежных позвонков (развитие спондилеза), межпозвонковых суставов и связочного аппарата позвоночника. Остехондроз позвоночника является самой частой причиной дорсопатий. Дорсопатии – группа заболеваний костно–мышечной системы и соединительной ткани, ведущим симптомокомплексом которых является боль в туловище и конечностях невисцеральной этиологии. По образному выражению А. Брейтера, «когда приходит время собирать камни, уже трудно нагибаться».
Неврологические проявления остеохондроза по¬зво¬ночника составляют до 80% всех заболеваний периферической нервной системы. Так, например, боль в нижней части спины в течение жизни возникает у 70–90% людей. Обострение данного заболевания со¬ставляет 32–161 дней на 100 работающих в год, что ве¬дет к значительным экономическим потерям. На первом месте по частоте встречаемости стоят поражения по¬яснично–крестцового отдела позвоночника (60–80%), а на втором – шейного отдела позвоночника (около 10%). Клинически остеохондроз позвоночника проявляется в виде рефлекторного синдрома (встречается в 90% случаев) и компрессионного (выявляется в 5–10% случаев).
Рефлекторные синдромы возникают вследствие раздражения болевых рецепторов (ноцицепторов) задней продольной связки в результате реализации одного или нескольких патологических факторов и сопровождаются рефлекторной блокировкой соответствующего позвоночного двигательного сегмента за счет напряжения мышц (в частности, поперечнополосатых) с созданием мышечного «корсета». Однако мышечный спазм приводит к усилению стимуляции ноцицепторов самой мышцы, вследствие чего спазмированная мышца становится источником дополнительной ноцицептивной импульсации (так называемый порочный круг «боль – мышечный спазм – боль»). Рефлекторные синдромы подразделяют на мышечно–тонические (например, синдром передней лестничной мышцы), нейрососудистые (синдром плечо–кисть) и нейродистрофические (плечелопаточный периартроз).
Компрессионные синдромы обусловлены механическим воздействием грыжевого выпячивания, костных разрастаний или другой патологической структуры на ко-решки, спинной мозг или какой–либо сосуд. Ком¬прес¬сионные синдромы, в свою очередь, делят на ко¬решковые (радикулопатии, наиболее часто наблюдается компрессия корешка L5), спинальные (миелопатии) и нейрососудистые (синдром позвоночной артерии) синдромы. При компрессионном синдроме боли локализуются в позвоночнике с иррадиацией в конечность (проекционная боль), которая усиливается при движении в позвоночнике, в то время как при рефлекторном синдроме боль локальная, без иррадиации (местная боль) и усиливающаяся при нагрузке на спазмированную мышцу. При компрессионном синдроме также определяются симптомы выпадения функции компрессированных корешков: нарушение чувствительности, гипотрофия мышц, снижение сухожильных рефлексов (чего не наблюдается при рефлекторном синдроме) [1].
Однако в настоящее время отмечается очевидная гипердиагностика остеохондроза позвоночника, как основной причины болевого синдрома. Так, обычно недооценивается роль миофасциальных синдромов в происхождении боли (страдают от 35 до 85% населения). Миофасциальные болевые синдромы раньше называли миозитом или миалгией. Суть миофасциального болевого синдрома заключается в том, что мышца страдает первично, а не вслед за морфологическими или функциональными нарушениями в позвоночнике. В патологический процесс может вовлекаться любая мышца или группы мышц. Одна из наиболее частых причин формирования миофасциального болевого синдрома – острое перерастяжение самой мышцы при выполнении «неподготовленного» движения. Обычно больной точно помнит, какое движение или действие вызвало появление боли [3].
Для постановки диагноза миофасциального болевого синдрома необходимо выявить следующие клинические признаки:
– при пальпации мышца спазмированная;
– на фоне спазмированной мышцы четко определяются зоны еще большего болезненного мышечного уплотнения;
– в пределах спазмированной мышцы выявляются активные триггерные точки, отличающиеся особой болезненностью.
При надавливании на активные триггерные точки боль ощущается не только в самой точке, но и иррадиирует в отдаленные от этой точки зоны – зоны отраженных болей (иррадиирующая боль). Отличить миофасциальные боли от корешковых можно с помощью простого теста. Надо попросить больного начертить линию (например, на ноге) соответственно локализации боли, которую он чувствует. При «корешковой боли» больной четко определит «маршрут», чего не наблюдается при миофасциальном болевом синдроме. В зависимости от «маршрута» можно определить, какой именно корешок страдает.
Дорсопатии могут протекать остро (до 3 недель), подостро (3–12 недель) и хронически (более 12 недель или 25 эпизодов в год). При этом, по данным ряда исследователей, в 80% случаев острые боли регрессируют самостоятельно или в результате лечения в течение 6 недель, однако в 20% случаев они принимают хроническое течение.
Лечение дорсопатий проводится с учетом формы заболевания и варианта его течения и включает медикаментозное, немедикаментозное (в том числе физиотерапевтическое) и оперативное виды лечения [5].
Основными задачами лечения являются:
– купирование болей;
– предупреждение хронизации болевого синдрома;
– обеспечение условий для проведения полноценного курса реабилитационных мероприятий;
– профилактика рецидива обострений.
Факторы, влияющие на эффективность восстановительного лечения:
• пол
• возраст
• вид боли
• интенсивность боли
• наличие болевого синдрома в анамнезе
• наличие депрессии
• адекватность проводимого лечения.
В США расходы на лечение больных с болями в позвоночнике ежегодно составляют 50 млрд. долларов. Однако при этом 7 млрд. долларов расходуются впустую вследствие неадекватного лечения.
В настоящее время медикаментозная терапия на¬правлена на уменьшение болевого синдрома (на¬прав¬ление терапии – symptoms modifying drugs) и стимулирование восстановительных процессов суставного хряща (направление терапии – structure modifying drugs).
При длительности болевого синдрома менее 1 недели оправдано назначение нестероидных противовоспалительных препаратов (НПВП), механизм действия которых связан с ингибированием синтеза простагландинов (повышение порога болевой чувствительности). На сегодня известно около 100 видов НПВП. Тем не менее, несмотря на многолетнюю историю применения данных препаратов, все еще остается ряд нерешенных проблем, касающихся оптимального лечения, в первую очередь – частое развитие побочных эффектов. Самы¬ми частыми побочными эффектами НПВП являются гастропатии (от 15 до 30%), вследствие чего более 10% пациентов прекращают прием лекарств. Однако при необходимости применения НПВП per os предпочтение отдается селективным ингибиторам циклооксигеназы второго типа. Кроме того, в остром периоде необходимо сочетать НПВП с бензодиазепиновыми транквилизаторами (усиление обезболивающего действия НПВП и уменьшение тревоги вследствие боли).
Если боль сохраняется до 3 месяцев, то НПВП сочетают с неопиоидными анальгетиками центрального действия и миорелаксантами. Неопиоидные анальгетики центрального действия за счет стабилизации мембранного потенциала позволяют «стереть» болевую память (что препятствует процессу хронизации боли). Одно¬вре¬менное же сочетание миорелаксантов с НПВП способствует не только усилению обезболивающего эффекта, но и снижению дозы последних в 2 раза, тем самым уменьшая риск развития гастропатий.
При болевом синдроме длительностью более 3 месяцев показаны НПВП в сочетании с неопиоидными анальгетиками центрального действия и антидепрессантами. Среди антидепрессантов наиболее часто применяют трициклические антидепрессанты. Что касается селективных ингибиторов обратного захвата серотонина, то они изначально не были синтезированы в качестве обезболивающего средства. Хотя необходимо отметить, что боль является симптомом – «маской» соматизированной депрессии. Так, по данным литературы, 47,8% больных с остеохондрозом позвоночника страдают депрессией. С другой стороны, депрессия – независимый предиктор развития интенсивной боли (порочный круг «боль – депрессия – боль – депрессия»). Вы¬ра-женная депрессия в 4 раза повышает риск обострения болевого синдрома. Все это делает оправданным применение данных препаратов при лечении болевого синдрома [4].
С целью улучшения обменных процессов в пораженных дисках рекомендовано использование хондропротекторов. В основе действия хондропротекторов лежат:
– активация синтеза хряща и регенерации матрикса соединительной ткани путем введения в организм профакторов синтеза мукополисахаридов (хондроитинсульфат, глюкозамин);
– подавление катаболических (цитокин–зависимое разрушение хряща, инактивация матриксных металлопротеиназ) процессов в хряще;
– стимуляция синтетических функций хондроцитов.
Среди современных хондропротекторов внимания заслуживает Структум (1 капсула препарата содержит 500 мг хондроитин сульфат натрия). Взрослым назначают по 500 мг 2 раза в сутки. Рекомендуемая продолжительность начального курса терапии составляет 6 ме¬сяцев.
Ряд проведенных исследований показали высокую эффективность Структума при болях в нижней части спины (БНС). Так, по данным Н.А. Шостак с соавт. (2003), эффективность препарата при данной патологии составила 73,3%, что подтверждалось достоверным (р<0,05) снижением показателей ВАШ (с 66,8±4,3 до 21,8±3,2 мм) и улучшением функционального состояния позвоночника (снижение индекса нетрудоспособности Вадделя в 2,4 раза после 6 месяцев лечения). Кроме того, согласно исследованию В.И. Мазурова с соавт. (2004) применение Структума способствует уменьшению потребности в НПВП у 35% и позволяет отменить их у 25% больных.
При хроническом течении патологического процесса рекомендовано проведение повторных курсов лечения, продолжительность которых устанавливается индивидуально.
Одной из причин неудовлетворительных результатов лечения пациентов с болью в спине нередко является применение какого–либо одного метода [Lang et al., 2000]. Хороший эффект отмечается при лечении по мультимодальной программе активизации Геттингера (GRIP – Gottinger – Rucken – Intensiv – Program). Суть программы заключается в восстановлении физической активности пациента, который при этом несет ответственность за результат лечения (Hildebrand et. al., 1996). Особое место в программе принадлежит сочетанию приема хондропротекторов с физио– и кинезитерапией.
Так, в остром периоде назначают:
– постельный режим в течение 2–4 дней (при рефлекторных синдромах), 5–14 дней (при корешковых);
– принятие анталгической позы в постели (для уменьшения болевого синдрома);
– применение иммобилизирующих ортезов (воротник Шанца при шейном остеохондрозе), жесткое ложе (щит) при вертеброгенных синдромах грудного и поясничного остеохондроза;
– диадинамические (ДДТ), синусоидальные модулированные (СМТ) токи (последовательное воздействие на несколько полей (методика «погоня за болью»);
– магнитотерапия (сочетание магнитотерапии с ДДТ–, СМТ–терапией);
– мезодиэнцефальная модуляция;
– с 5–6–го дня заболевания проводится укрепление мышечного корсета с помощью щадящей гимнастики (в разгрузочных позах).
В подостром периоде:
– лекарственный электрофорез (миорелаксанты, вазоактивные препараты), проводимый с помощью ДДТ или СМТ токов;
– лазеротерапия (сочетание с магнитотерапией);
– фонофорез (сочетании с магнитотерапией);
– устранение функциональных блоков (тракционное вытяжение, мануальная терапия (методика пост¬изометрической релаксации);
– индивидуальная лечебная гимнастика;
– массаж;
– рациональная психотерапия (особенно при персистенции болевого синдрома).
В стадии неполной ремиссии:
– грязелечение (СМТ–грязелечение) в сочетании с магнитотерапией,
– скипидарные ванны,
– радоновые ванны,
– контрастные ванны,
– бассейн,
– подводный душ–массаж,
– сауна [2].
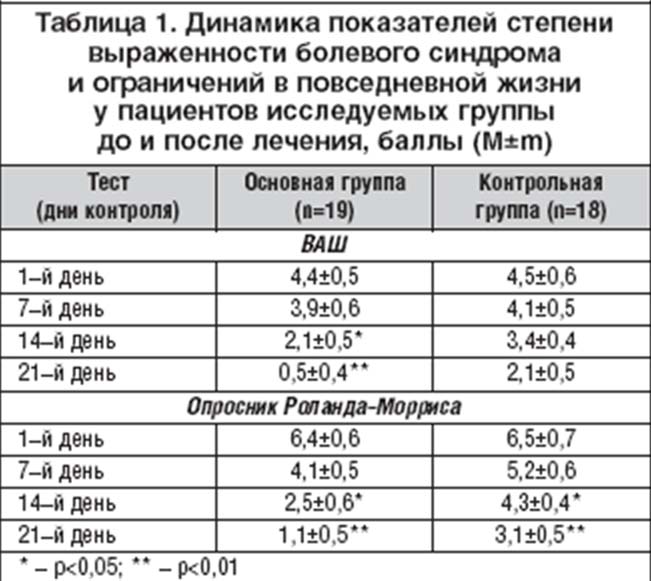
Для оценки эффективности комплексного подхода к восстановительному лечению больных с болями в спине нами проведены собственные исследования. Под наблюдением находилось 37 пациентов (средний возраст 51,6±3,4 лет) с давностью болевого синдрома 14,6±3,9 дней. Все больные были разделены на основную (19 человек) и контрольную (18 человек) группы. Пациенты основной группы на фоне приема хондропротекторов получали физио– и кинезотерапию. Больные же контрольной группы – лишь немедикаментозные методы лечения.
Оценку степени регресса болевого синдрома проводили с помощью Визуальной аналоговой шкалы (ВАШ), а степень нарушения жизнедеятельности и социальных ограничений – опросника «Боль в нижней части спины и нарушение жизнедеятельности» Ро¬лан¬да–Морриса (1997). Повторное тестирование проводили через 7, 14 и 21–дни от момента начала лечения. Как показали результаты исследования степень выраженности болевого синдрома по шкале ВАШ до лечения составила 4,4±0,5 и 4,5±0,6 баллов, а степень нарушения жизнедеятельности – 6,4±0,6 и 6,5±0,7 баллов соответственно в обеих группах (p>0,5)
Результаты повторных исследований на фоне проводимого лечения представлены в таблице. Как видно из таблицы 1, включение в комплексную программу восстановительного лечения наряду с физио–, и кинезитерапией хондропротекторов (таких, как Структум) способствует значительному уменьшению болевого синдрома и улучшению «качества жизни» больных уже на 2–й неделе лечения (p>0,05).
В стадии неполной ремиссии остеохондроза позвоночника больного можно направить на санаторно–ку¬рорт¬ное лечение (в частности, для лечения радоном). Вы¬со¬ко¬эф¬фективный метод лечения – методика сочетания питье¬вого приема радоновой воды и общих радоновых ванн (теория «биопозитивного действия» радонотерапии):
• при приеме радоновой воды внутрь радон и его дочерние продукты образуют депо в желудке и его со¬держимом, откуда постепенно поступают в кровь и внутренние органы, способствуя более равномерному облучению в необходимой дозе;
• лечебное действие радоновых процедур связано с улучшением регуляции основного обмена, нейросекреторных и нейрогормональных реакций, периферического кровообращения и иммунных процессов [В.М. Бо¬голюбов, 2007].
Особое внимание следует уделить показаниям к оперативному лечению. По данным литературы, лишь 0,3% больных нуждаются в оперативных вмешательствах. Абсолютным показанием к операции является острое сдавление спинного мозга и корешков конского хвоста, проявляющееся тазовыми нарушениями, двусторонними болями и парезами. Относительным показанием к оперативному лечению является стойкость болевых синдромов при отсутствии эффекта от консервативной терапии (на протяжении 3–х и более месяцев). Однако даже при микрохирургических дискэктомиях с эффективностью до 80% сохраняется опасность развития послеоперационных осложнений. Так, в последние годы даже появился термин «синдром неудачных операций на поясничном отделе позвоночника» (Failed Back Surgery Syndrome – FBSS), который встречается от 5–10 до 15–50% всех операций в зависимости от характера оперативных пособий. Данный синдром характеризуется наличием постоянных поясничных или корешковых болей у пациентов, перенесших одно или несколько оперативных вмешательств по поводу заболеваний позвоночника.
Итак, основной целью лечения болей в спине является улучшение качества жизни пациентов. «Счастье – это избавление от боли» (А. Шопенгауэр).
Выводы
1. Неврологические проявления остеохондроза позвоночника составляют до 80% всех заболеваний пе¬риферической нервной системы. На первом месте по частоте встречаемости стоят поражения пояснично–крестцового отдела позвоночника.
2. Современная терапия направлена на уменьшение болевого синдрома и стимулирование восстановительных процессов суставного хряща. С целью улучшения обменных процессов в пораженных дисках рекомендовано использование хондропротекторов.
3. Среди современных хондропротекторов внимания заслуживает Структум. Применение препарата способствует предотвращению хронизации болевого синдрома.
4. Эффективность лечения повышается при сочетании хондропротекторов с физио– и кинезитерапией.
Литература
1. Гусев Е.И. Нервные болезни – М., 1988 – 637 с.
2. Гурленя А.М, Багель Г.Е. Физиотерапия и курортология нервных болезней – Минск, 1989 – 397 с.
3. Леонович А.Л. Актуальные вопросы невропатологии – Минск, 1990 – 207 с.
4. Маркин С.П. Лечение больных с неврологическими проявлениями остеохондроза позвоночника. Методические рекомендации – М., 2005 – 38 с.
5. Попов П.С. Справочник по курортологии и физиотерапии заболеваний нервной системы – Кишинев, 1989 – 278 с.
Ключевые слова статьи: Современный, взгляд, проблему, боли, позвоночнике
12 мая 2009 г, том 17, № 11
РМЖ Неврология. Психиатрия













