Современные пути лечения остеоартроза
Хитров Н.А.
В настоящее время можно пересмотреть известное образное выражение о том, что остеоартроз (ОА) – это «золушка» в артрологии. В последние годы заболеванию уделяется все более пристальное внимание из–за обнаружения сложных и разнообразных механизмов его развития, возрастания частоты встречаемости, высокой инвалидизации при ОА.
ОА – гетерогенная группа заболеваний различной этиологии со сходными биологическими, морфологическими, клиническими проявлениями и исходом, в основе которых лежит поражение всех компонентов сустава, в первую очередь хряща, а также субхондральной кости, синовиальной оболочки, связок, капсулы околосуставных мышц. Вторичные воспалительные процессы и прежде всего синовит, сопровождают течение ОА, играют значительную роль как в формировании клиники болезни, так и в дальнейшей деструкции суставных структур [4].
Синовит при ОА усугубляет клинику ОА, обостряя все симптомы, и снижает качество жизни больного. Главная трагедия синовита при ОА состоит в его деструктивном действии на хрящ за счет активации литических ферментов на фоне активации фагоцитарных, воспалительных, иммунных и ферментноклеточных реакций, которые усиливают катаболические процессы в структурах сустава.
ОА является распространенной формой суставной патологии, им болеет 10–20% населения. Заболевание коррелирует с возрастом, чаще развивается после 30–35 лет. Признаки ОА встречаются в 90% людей старше 70 лет.
До конца не установлен эпицентр поражения при ОА – хрящ или субхондральная кость, откуда хрящ получает питание. Суставной гиалиновый хрящ не имеет нервных окончаний и кровеносных сосудов и остается открытым вопрос, откуда он получает питание: из внутрисуставной синовиальной жидкости или субхондральной кости? При ОА дегенеративные процессы в хряще и в субхондральной кости протекают параллельно.
Симптоматика при ОА включает болевой синдром, уменьшение объема движений, минимальную утреннюю скованность менее 30 мин., нестабильность сустава, крепитацию, отек. Болевой синдром, наиболее частный и выраженный симптом при ОА – явление неоднородное и включает в себя ряд причинных факторов [4,11].
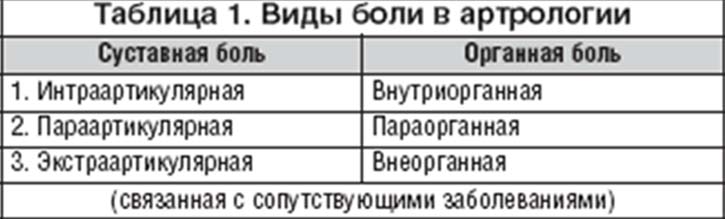
К развитию болевого синдрома следует подходить с учетом жизнедеятельности целостного организма и рассматривать боль не как местный патологический процесс, а как общее расстройство, при котором играют роль факторы конституциональной неполноценности в системе соединительной ткани. Сустав является основным органом–мишенью поражения при ОА, суставная боль наиболее часто определяет клинику заболевания. Рассматривая суставы как структурную единицу организма, морфофункционально связанную с другими тканями и системами, боль при ОА необходимо расценивать как интраартикулярную, параартикулярную и экстраартикулярную, связанную с сопутствующими поражениями других органов и систем, а в широком смысле боль можно представить как внутриорганную, параорганную и связанную с сопутствующими заболеваниями (табл. 1).
Интраартикулярная боль при ОА носит неоднородный характер. В целом для ОА характерен механический ритм болей – возникновение боли под влиянием физической нагрузки и стихание за период отдыха, что связано со снижением амортизационных способностей хряща и подхрящевых костных структур к нагрузкам.
Возможны ночные боли, связанные с венозным стазом и повышением кровяного внутрикостного давления в спонгиозной части кости. Нередко боли в пораженных суставах усиливаются под влиянием неблагоприятных метеорологических условий – высокого атмосферного давления, низкой температуры, повышения влажности, которые могут воздействовать на интраартикулярные барорецепторы.
Кратковременная «стартовая боль» возникает при первых движениях после покоя и вскоре проходит на фоне двигательной активности. Стартовые боли обусловлены трением суставных поверхностей, на которых оседает детрит – продукт разрушения хрящевой ткани. В процессе нескольких движений в суставе детрит выталкивается в завороты суставной сумки, и боли прекращаются.
Возможна так называемая блокада сустава – быстро развивающийся резко выраженный болевой синдром вследствие ущемления «суставной мыши» – костного или хрящевого фрагмента между суставными поверхностями. При этом боль лишает больного возможности выполнять малейшие движения в данном суставе. Блокаде коленного сустава способствует часто развивающаяся при ОА дегенеративная менископатия.
Боли при движении, «стартовая» боль и «блокада сустава» объясняются нарушениями его кинематики, поэтому в покое данная болезненность, как правило, уменьшается. ОА – первично хроническое заболевание, человек, у которого он возник, обречен страдать им навсегда и сталкивается с суставной болью на протяжении всей своей оставшейся жизни. В данных случаях боль носит охранительный характер и, как «сторожевой пес здоровья», определяет лечебный щадящий двигательный режим для больного, является своего рода индикатором адекватности физической нагрузки на суставы.
Иной механизм боли формируется при синовите. Тогда появляется постоянная боль, связанная с длительной сенситизацией ноцицепторов в процессе воспаления. Данную боль, которой сопутствуют утренняя скованность, припухлость сустава, локальное повышение кожной температуры, можно трактовать как хроническую, которая в сочетании с вегетативными, психологическими и эмоциональными факторами теряет приспособительное биологическое значение. Это обусловливает лечение хронического болевого синдрома препаратами, подавляющими воспаление, к которым прежде всего относятся НПВП [1,6,8,12].
Параартикулярная боль при ОА связана с поражением околосуставного аппарата, который наравне с собственно суставами отвечает за двигательную активность человека. При ОА у пожилых людей часто отмечаются дегенеративные изменения параартикулярных мягких тканей: фиброз мышечной ткани, кальцифицирующие и оссифицирующие тендиниты. Ишемические, нейротрофические, фиброзно–склеротические нарушения приводят к воспалительным и дистрофическим изменениям в параартикулярных структурах с болевым синдромом. Изменение стереотипа движений в артрозном суставе увеличивает компенсаторную нагрузку на параартикулярный аппарат с развитием локальных лигаментитов, теносиновитов, миозитов, бурситов, энтезопатий.
Экстраартикулярная боль при ОА связана с сопутствующими заболеваниями, которые значительно чаще обнаруживается у пожилых пациентов. Парестезии нижних конечностей при атеросклеротическом дисциркуляторном поражении ЦНС, клиника застойной сердечной недостаточности по большому кругу кровообращения, атеросклероз сосудов нижних конечностей существенно влияют на боли в коленных суставах у данных больных.
Болевой синдром является краеугольным камнем клиники ОА, во многом определяющим другие симптомы. Суставная боль при ОА меняет лимфо– и кровоток в суставе, усугубляя его трофику, усиливая внутрисуставные процессы дегенерации, деградации и деструкции хряща и субхондральной кости. Усиление боли вызывает реактивный спазм близлежащих мышц, принимающих участие в движении сустава, что приводит к контрактурам суставов. Изменения характера боли характерно при усилении синовита. Болевой синдром при ОА уточняет диагноз, определяет двигательный режим и отражает качество проводимой терапии.
Лечение ОА до конца не разработано, доказательством чего являются многочисленные операции по замене дегенеративно разрушенных суставов искусственными [4,13].
Определяющим фактором лечения ОА является механическая разгрузка сустава. Сюда входят рекомендации по снижению веса тела при ожирении, исключение длительного пребывания в фиксированной позе, долгого стояния на ногах, длительной ходьбы, повторяющихся стереотипных движений, переноса больших тяжестей, что ведет к механической перегрузке поврежденных поверхностей суставов. Лечебная физкультура должна проводиться в положении сидя или лежа, в безболевой зоне с включением пассивных движений.
Простые анальгетики, наиболее часто используемые при ОА, как ни странно, наименее приемлемы, т.к. не действуют на патогенетические звенья синовита, что нивелирует их эффект. Кроме того, простые и опиоидные анальгетики вызывают феномен «анальгетической личности», при которой больной, не чувствуя боли, чрезмерно расширяет свою двигательную активность, которая не улучшает, а усугубляет как вторичное воспаление, так и клинику болезни. Назначение миорелаксантов при ОА, патогенетически обусловленное, проблематично в применении у пожилых больных, т.к. может ухудшить координацию движений больного [1,7,12].
Внутрисуставные инъекции глюкокортикостероидов (ГКС) в пораженный сустав показаны при ОА не чаще 2 раз в год. Если возникает необходимость более частого их введения, то необходимо пересматривать всю терапию ОА у данного больного [4].
Особенности локальной стероидной терапии (ЛСТ) при ОА определяется следующим.
1. Редкость ЛСТ вытекает из отрицательного воздействия ГКС на хрящ и субхондральную кость.
2. Системное воздействие ГКС проявляется в повышении веса, АД, поражении ЖКТ, развитии остеопороза – заболеваниях, которые часто сопутствуют как самому ОА, так и обусловлены его лечением.
3. ЛСТ показана и эффективна только при обострении синовита, что вынуждает проводить четкий клинический динамический мониторинг врачом клиники конкретного курируемого больного ОА.
4. Технически удалять жидкость из сустава и вводить ГКС в его полость достаточно сложно, т.к. деформированная суставная щель сужена из–за развития остеофитов, капсула сустава фиброзно склерозирована, воспалительного экссудата в полости сустава при ОА мало в сравнении с синовитом при первичных артритах.
5. Действие пролонгированных ГКС при ОА короткое. Если эффект ГКС при артритах сохраняется более 1 мес., то при ОА – не более 3 недель.
Хондропротекторы – лекарственные средства, содержащие структурные элементы хрящевой ткани, призваны замедлить катаболические процессы в хрящевой ткани. Мы лишь ждем прорыва в создании новых препаратов данной группы с высоким клинико–морфологическим эффектом. Осложняют анализ эффективности хондропротекторов сложность прижизненной оценки толщины и структуры хряща.
Финальной стадией лечения ОА являются ортопедические коррекции в виде назначения тростей, ортезов, корригирующих остеотомий, эндопротезирования.
Акценты лечения
При подходе к лечению ОА автор основывался на нескольких положениях.
1. Боль при ОА, являющаяся ведущим симптомом и причиняющая мучительные страдания, требует скорейшего лечения. Эффективное купирование болевого синдрома является первоочередной задачей фармакотерапии ОА, т.к. боль является одним из наиболее тягостных ощущений, определяющих тяжесть страданий и изменение качества жизни пациента. Быстрота достижения и стойкость анальгетического эффекта относятся к основным критериям оценки адекватности лечения – по крайней мере, с точки зрения больного [3,7].
2. Лечение необходимо проводить в короткие сроки, чтобы активный синовит, утяжеляющий боль, был быстро купирован и не оказал патологического деструктивного воздействия на суставные ткани. При ОА острый болевой синдром обычно сопровождается выраженной воспалительной реакцией.
3. На сегодняшний день не вызывает сомнения, что назначение нестероидных противовоспалительных препаратов (НПВП) не просто желательно, но определенно показано всем больным с ревматическими заболеваниями, испытывающим боли, связанные с острым или хроническим поражением опорно–двигательного аппарата. НПВП – важнейший класс лекарств, используемых для патогенетической терапии болевого синдрома (особенно в тех ситуациях, когда развитие боли тесно связано с процессами тканевого воспаления). Их отличает хорошо доказанная эффективность, предсказуемость фармакологического действия, доступность и удобство применения [3].
НПВП имеют несомненные преимущества по сравнению с другими классами анальгетиков. В отличие от опиоидов современные НПВП исключительно редко вызывают серьезные осложнения со стороны центральной нервной системы, к ним не развивается привыкание, а потому они не имеют каких–либо формальных ограничений для выписки и приобретения.
4. Длительное или постоянное применение НПВП нецелесообразно ввиду повышения риска развития осложнений, а также отрицательного влияния ряда препаратов этой группы на метаболизм хряща. Поэтому данные препараты рекомендуются больному на период обострения ОА [9,14,17].
Необходимо помнить, что как лечебная эффективность, так и переносимость различных НПВП у каждого пациента индивидуальна и при назначении их необходим персональный подход с оценкой как эффективности, так и побочных действий применяемого лекарственного вещества.
Необходимо помнить, что уменьшение суставной боли при приеме НПВП может побудить пациента к нарушению режима, увеличению двигательной активности.
5. Множество соматических заболеваний сопутствуют ОА, особенно часто у пожилых людей. Терапия не должна иметь побочных действий, чтобы не усугубить клинику сопутствующих болезней. Хорошо известно, что основное фармакологическое действие НПВП связано с блокадой циклооксигеназы–2 (ЦОГ–2), фермента, активно синтезирующегося в очагах повреждения и воспаления клетками воспалительного ответа и отвечающего за синтез важнейших медиаторов боли и воспаления – простагландинов. Осложнения, возникающие при приеме НПВП (прежде всего со стороны ЖКТ), традиционно связываются с подавлением «физиологической» формы ЦОГ – ЦОГ–1, играющей важную роль в поддержании многих параметров гомеостаза человеческого организма, в том числе защитного потенциала слизистой оболочки [10,15].
Тем не менее «физиологическая» ЦОГ–1 также принимает участие в процессе развития воспаления, и поэтому подавление ее активности в области повреждения (не во всем организме!) может рассматриваться как положительный момент. Именно такое свойство имеет мелоксикам, обладающий умеренной селективностью в отношении ЦОГ–2, практически не влияющий на «физиологическую» ЦОГ–1 в слизистой оболочке желудка, но эффективно подавляющий ее в очагах воспаления [2,3,5,20].
Важно то, что, помимо основного действия (блокады ЦОГ), мелоксикам имеет ряд иных фармакологических свойств, позволяющих прогнозировать его высокую эффективность при лечении боли и воспаления: это влияние на синтез важнейших провоспалительных цитокинов (интерлейкин–6, фактор некроза опухоли–a), блокада синтеза металлопротеиназ, антигистаминное действие, снижение активности в очагах воспаления агрессивных клеток (макрофагов и нейтрофилов), а также другие противовоспалительные механизмы.
6. Для борьбы с болевым и противовоспалительным синдромом при ОА желательно использовать внутримышечный способ введения лекарственного препарата, как, с одной стороны, быстродействующий, а с другой – оказывающий минимальное побочное воздействие на ЖКТ.
Учитывая отрицательное воздействие НПВП на ЖКТ, возможно альтернативное назначение их в виде ректальных свечей и внутримышечных инъекций, хотя при этом также сохраняется риск развития гастропатий. При назначении НПВП нужно оценить анамнез больного, также факторы риска в плане развития желудочно–кишечных заболеваний, сориентировать его на рациональную диету, а также прием медикаментов, защищающих слизистую желудка.
Для лечения болевого и воспалительного синдрома был выбран Амелотекс – международное непатентованное название мелоксикам – НПВП, относящийся к классу оксикамов, производных энолиевой кислоты, обладающий анальгетическим, противовоспалительным и жа¬ропонижающим действием. Амелотекс селективно ингибирует ферментативную активность ЦОГ–2, подавляет син¬тез простагландинов в области воспаления в большей степени, чем в слизистой оболочке желудка или почках, реже вызывает эрозивно–язвенные поражения ЖКТ по сравнению с обычными НПВП. Амелотекс выпускается в виде раствора для внутримышечного введения, 1 ампула (1,5 мл) содержит в качестве активного вещества 15 мг мелоксикама.
Материал и методы исследования
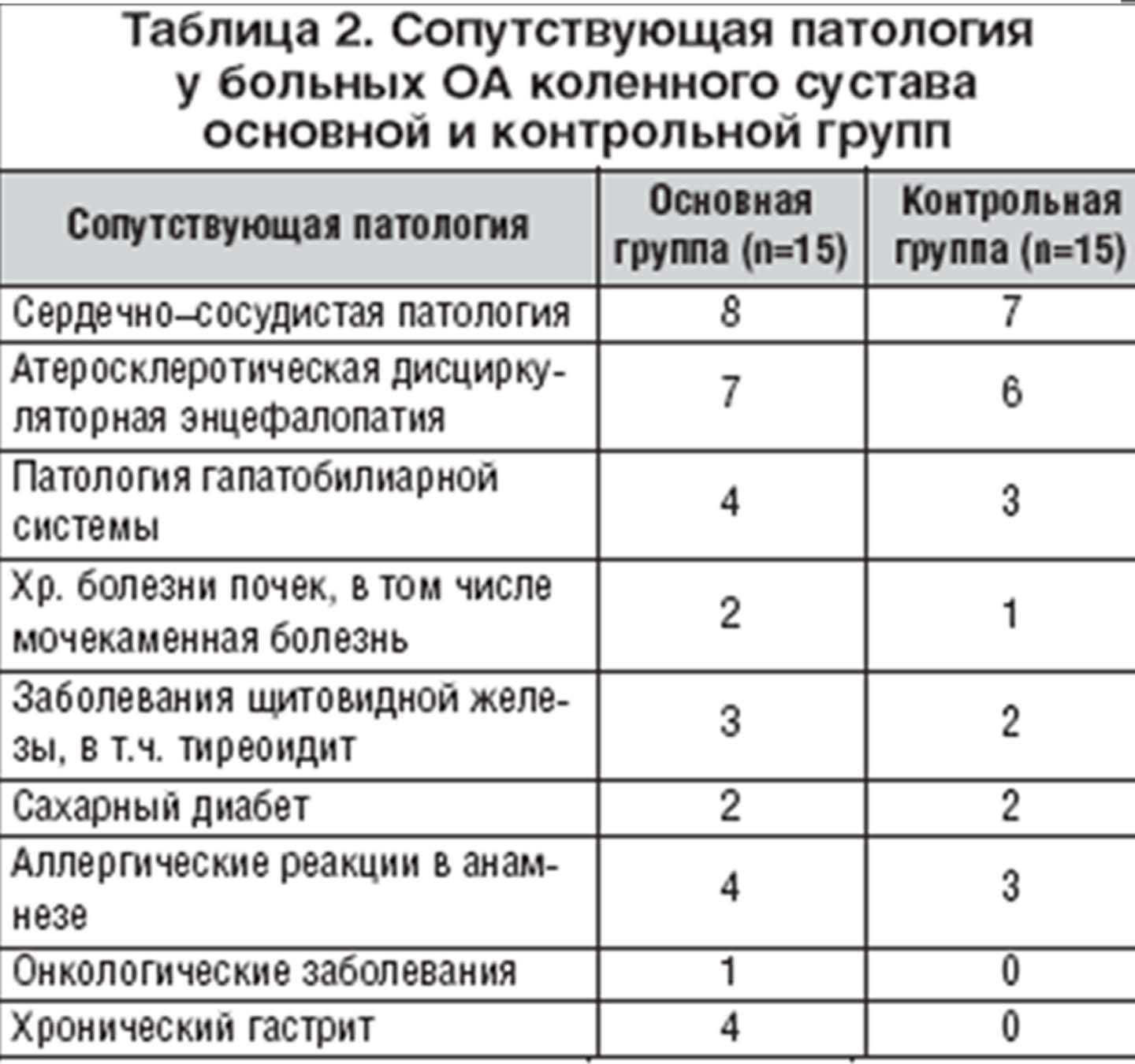
Было проведено открытое рандомизированное исследование по клинической эффективности и переносимости терапии ОА коленного сустава Амелотексом (основная группа – 15 больных) в сравнении с терапией диклофенаком, принятым за «золотой стандарт» НПВП (контрольная группа – 15 больных) [16,18,19]. В основную группу вошли 2 мужчин и 13 женщин среднего возраста 61,3±9,4 года и с давностью заболевания 6,5±4,3 года. I рентгенологическая стадия ОА по Kellgren отмечена у 2 больных, II – у 8 пациентов и III – у 5 больных. Контрольную группу составили 3 мужчины и 12 женщин, среднего возраста 59,7±8,5 года, и давностью болезни 5,8±3,9 года. I рентгенологическая стадия ОА по Kellgren выявлена у 4 пациентов, II – у 7 больных и III – у 4 больных. Таким образом, основная и контрольная группы сопоставимы по полу, возрасту, давности и стадии заболевания. Сопутствующие заболевания больных ОА представлены в таблице 2, из которой видно, что в основной группе Амелотекс получали 4 пациента с хроническим гастритом (которым неспецифические ингибиторы ЦОГ применять было нежелательно).
В основной группе Амелотекс назначался по 1,5 мл внутримышечно 1 раз/сут. в течение 5 дней, в контрольной группе диклофенак назначался по 3 мл также внутримышечно 1 раз/сут. 5 дней. На фоне лечения как Амелотексом, так и диклофенаком другая терапия не проводилась, кроме стандартных рекомендаций по режиму. Также другие методы лечения в обеих группах не использовались в течение 2 недель до начала лечения Амелотексом и диклофенаком. Внутрисуставные и параартикулярные инъекции стероидов не проводились пациентам за 1 мес. до начала терапией внутримышечными НПВП.
В начале и в конце 5–дневной терапии НПВП проводился общеклинический осмотр пациентов обеих групп. Ежедневно определялась выраженность боли в коленном суставе (по 100–миллиметровой визуальной аналоговой шкале – ВАШ). В начале и в конце лечения измерялись окружность коленного сустава на уровне середины надколенника в сантиметрах, объем движения в суставе в угловых градусах, оценивалась функциональная недостаточность по опроснику WOMAC (Western Ontario and McMaster University Osteoartritis Index). Также в начале и в конце лечения у больных оценивались показатели общего и биохимического анализов крови, общий анализ мочи. В начале и в конце лечения у больных оценивалась электрокардиограмма. При клинической констатации жидкости в суставе больным ОА выполнялось ультразвуковое исследование сустава в начале и в конце лечения. В процессе лечения анализировались побочные явления, а в конце терапии больной оценивал ее эффективность.
Полученные результаты
На фоне проведенного лечения как Амелотексом, так и диклофенаком у значительного большинства пациентов уменьшилась боль в суставе, как следствие улучшалось самочувствие, повысилось настроение, уменьшилась раздражительность и нормализовался сон, прежде всего за счет уменьшения ночных болей.
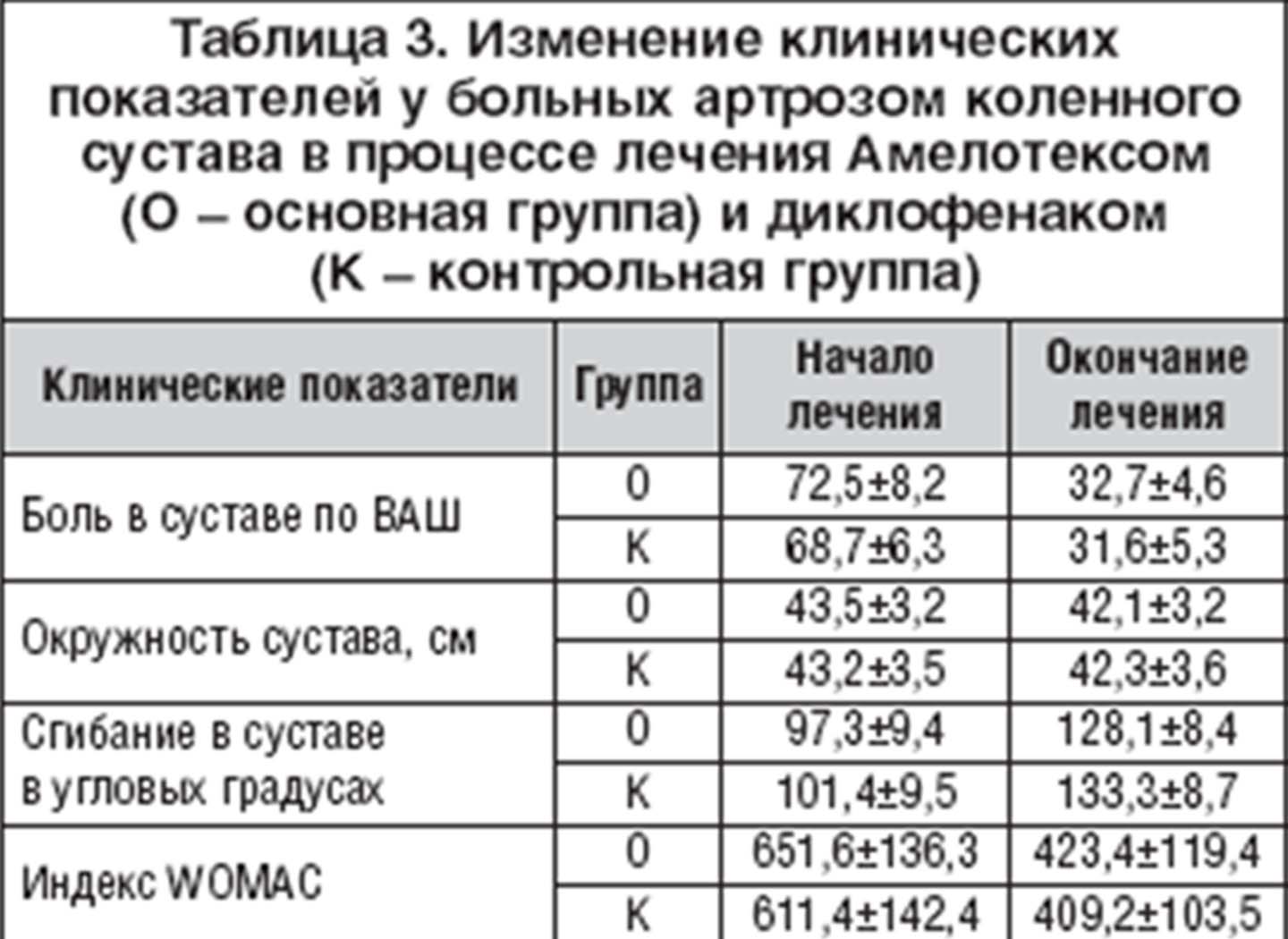
До начала лечения Амелотексом боль, по оценке больных по ВАШ, равнялась 72,5±8,2 мм, в конце лечения боль составила 32,7±4,6 мм. До начала лечения диклофенаком боль равнялась 68,7±6,3 мм, в конце лечения боль уменьшилась до 31,6±5,3 мм, т.е. в обеих группах в процессе лечения боль достоверно уменьшилась (p<0,01). Средняя окружность больного коленного сустава в основной группе изначально составила 43,5±3,2 см, в конце лечения уменьшилась до 42,1±3,2 см. Средняя окружность сустава в контрольной группе уменьшилась с 43,2±3,5 до 42,3±3,6 см. Объем сгибания в коленном суставе в среднем в основной группе изначально равнялся 97,3±9,4° а через 5 дней – 128,1±8,4°. Средний объем сгибания в контрольной группе увеличился с 101,4±9,5° до 133,3±8,7°.
Уменьшение болей и увеличение амплитуды движений в суставе привели к положительной динамике индекса WOMAC, сопоставимого в обеих группах. До лечения суммарный индекс WOMAC в основной группе составил 651,6±136,3 мм, а в конце лечения снизился до 423,4±119,4 мм. Индекс WOMAC в контрольной группе уменьшился с 611,4±142,4 мм до 409,2±103,5 мм (табл. 3).
По окончании лечения Амелотексом значительное улучшение отметили 8 больных, улучшение – 6, отсутствие динамики – 1 больной. На фоне терапии диклофенаком значительное улучшение отметили 6 больных, улучшение – 7, отсутствие динамики – 2 больных. Отрицательной динамики при лечении пациентами обеих групп не отмечено.
В обеих группах при лечении часть больных испытывала страх перед уколом и неприятные ощущения в процессе проведения инъекции. При лечении диклофенаком у 1 больной отмечалось повышение АД, потребовавшее дополнительной медикаментозной коррекции. Также у 1 больной при лечении диклофенаком отмечены явления диспепсии, что послужило поводом к консультации гастроэнтеролога. Побочных явлений в основной группе, леченной Амелотексом, в том числе у 4 больных с хроническим гастритом в стадии ремиссии, не выявлено.
Показатели общего анализа и биохимических констант крови существенно не менялись в процессе лечения. Также не отмечено существенных изменений показателей общего анализа мочи. Значимых отклонений по ЭКГ в процессе исследования выявлено не было. У 6 больных основной группы и у 5 больных контрольной группы отмечено значительное уменьшение количества жидкости в полости коленного сустава в конце лечения, по данным ультразвукового исследования, что вместе со снижением параартикулярных воспалительных процессов выразилось в уменьшении окружности коленного сустава.
Таким образом, при назначении больным, страдающим гонартрозом, 5–дневного внутримышечного курса Амелотекса отмечено его симптом–модифицирующее действие, проявившееся в уменьшении болевого синдрома, уменьшении припухлости в суставе, увеличении объема движений в суставе, уменьшении индекса WOMAC, сопоставимых с результатами лечения диклофенаком. Результаты проведенного исследования позволяют констатировать хорошую переносимость Амелотекса и его клиническую эффективность у обследованных больных.
На основании исследования можно сделать следующие выводы.
1. Лечение остеоартроза коленного сустава Амелотексом эффективно и проявляется снижением боли, уменьшением припухлости, увеличением подвижности в суставе, нормализацией функционального индекса.
2. Побочных действий и осложнений, повлекших отмену Амелотекса, не отмечено, в то время как в контрольной группе у 1 пациентки отмечено повышение АД и у 1 пациентки развилась клиника гастрита, потребовавшая дополнительной терапии.
3. Амелотекс целесообразно использовать при наличии противопоказаний к приему НПВП, а также при неэффективности других методов лечения.
Литература
1. Бадокин В.В. Пути оптимизации терапии остеоартроза // Русский медицинский журнал, 2006.– Т. 14.– № 25.– С. 1824–1824.
2. Годзенко А.А. Перспективы применения мелоксикама в лечении суставных синдромов // Русский медицинский журнал, 2006.– Т. 14.– № 25.– С. 1846–1848.
3. Каратеев А.Е., Барскова В.Г. Критерии выбора нестероидного противовоспалительного препарата. Справочник практического врача, 2007.– Т. 5.– № 5.– С. 13–17.
4. Клинические рекомендации. Ревматология / Под ред. Е.Л. Насонова.– М.: ГЭОТАР–Медиа, 2005 .– С. 99–111.
5. Насонов Е. Л. Кардиоваскулярные осложнения ингибиторов ЦОГ–2 – вопросов больше, чем ответов. Русский медицинский журнал, 2005.– Т. 13.– № 7.– С. 383–391.
6. Насонов Е.Л. Нестероидные противовоспалительные препараты в ревматологии. Лечащий врач, 2006.– № 2.– С.3–6.
7. Насонов Е.Л., Каратеев А.Е. Применение нестероидных противовоспалительных препаратов. Клинические рекомендации // Русский медицинский журнал, 2006.– Т. 14.– № 25.– С. 1769–1777.
8. Рациональная фармакотерапия ревматических заболеваний: рук. для практикующих врачей / Под общ. ред. В.А. Насоновой и Е.Л. Насонова.– М.: Литтерра, 2003.– 507 с.
9. Сороцкая В.Н., Каратеев А.Е. Желудочно–кишечные осложнения как одна из причин смерти больных ревматическими заболеваниями. Научно–практическая ревматология, 2005.– № 4.– C. 34–37.
10. Цветкова Е.С., Панасюк Е.Ю., Иониченок Н.Г., Рубцов О.В. Перспективы применения ингибиторов циклооксигеназы–2 при остеоартрозе. Consilium medicum, 2004, Т. 6.– №2.– С. 100.
11. Цурко В.В. Остеоартроз: проблема гериатрии.– М.: Изд. «Нью–диамед», 2004 .– 136 с.
12. Чичасова Н.В. Лечение хронического болевого синдрома в ревматологии. Лечащий врач, 2003.– №1.– С.16–19.
13. Brandt K.D. Diagnosis and nonsurgical management of osteoarthritis. Proffessional communications, 2000.– 304 p.
14. Ding C. Do NSAID affect the progression of osteoarthritis? Inflammation, 2002.– V. 26.– P. 139–142.
15. Feldman M., McMahon A.T. Do cyclooxigenase–2 inhibitors provide benefits similar to those of traditional nonsteroidal anti–inflammatory drugs, with less gastrointestinal toxicity? Ann. Intern. Med., 2000.– V. 132.– P. 134–143.
16. Gastrointestinal tolerability of meloxicam compared to diclofenac in osteoarthritis patients. International MELISSA Study Group. Meloxicam Large–scale International Study Safety Assessment. Br. J. Rheumatol., 1998.
17. Tannenbaum H., Bombardier C., Davis P., Russel A. For the Third Canadian Consensus Conference Group. J. Rheumatology, 2005.– V. 33.– P. 140–157.
18. Tavakoli M. Modelling therapeutic strategies in the treatment of osteoarthritis: an economic evaluation of meloxicam versus diclofenac and piroxicam. Pharmacoeconomics, 2003.– V. 21.– № 6.– P. 443–454.
19. Valat J.P., Accardo S., Reginster J.Y. A comparison of the efficacy and tolerability of meloxicam and diclofenac in the treatment of patients with osteoarthritis of the lumbar spine. Inflamm. Res., 2001.– V. 50.– Suppl. 1.– P. 30–34.
20. Zeidler H., Kaltwasser J.P., Leonard J.P. et al Prescription and Tolerability of Meloxicam in Day–to–Day Practice: Postmarketing Observational Cohort Study of 13,307 Patients in Germany. J. Clin. Rheumatol., 2002.–V. 8.– N. 6.– P. 305–315.
Источник Русский Медицинский Журнал 11 сентября 2009 г, том 17, № 21













