Как правильно использовать нестероидные противовоспалительные препараты
Каратеев А.Е.
Нестероидные противовоспалительные препараты (НПВП) – чрезвычайно широко используемое в клинической практике средство «первой линии» для симптоматической терапии ноцицептивной боли различного генеза. НПВП отличает уникальное сочетание обезболивающего, противовоспалительного и жаропонижающего действия [1]. Подобная комбинация терапевтических свойств особенно ценна для терапии ревматических заболеваний, таких, как ревматоидный артрит, болезнь Бехтерева, остеоартроз и дорсопатия – основной причины развития хронической боли в современном мире. По мнению главного ревматолога России академика РАМН, проф. Е.Л. Насонова, ценность НПВП в первую очередь заключается в том, что они способны «перекрывать» почти весь спектр основных симптомов ревматологической патологии [2].
Несомненно, что в руках опытного специалиста–терапевта НПВП являются надежным и удобным инструментом, позволяющим добиться быстрого облегчения страданий пациента и улучшения качества его жизни. Однако, как любой инструмент, эти препараты действенны и безопасны лишь в том случае, если их применяют правильно. Напротив, неумелое использование НПВП без учета их фармакологических свойств и индивидуальных особенностей пациента нередко оборачивается не только разочарованием в их эффективности, но и развитием опасных, угрожающих жизни осложнений.
Вообще вопрос безопасного использования НПВП имеет принципиальный характер, поскольку риск развития класс–специфических побочных эффектов оказывает существенное влияние на возможность их рационального использования. В первую очередь это касается опасности развития специфической патологии со стороны верхних отделов ЖКТ, характеризующейся наличием эрозий, язв и «гастроинтестинальных катастроф» – кровотечения и перфорации (НПВП–гастропатия). Риск появления данных осложнений у лиц, регулярно принимающих НПВП, возрастает по сравнению с популяцией более чем в 4 раза и составляет примерно 0,5–1 эпизод на 100 пациентов в год. Пациенты, регулярно принимающие НПВП, погибают от подобных осложнений в 2–3 раза чаще в сравнении с людьми, не принимающими каких-либо НПВП [1].
Не меньшее (а по мнению многих экспертов, даже большее) значение имеет риск развития осложнений со стороны сердечно–сосудистой системы. Прежде всего, речь идет о т.н. кардиоваскулярных катастрофах – инфаркт миокарда, внезапная коронарная смерть, ишемический инсульт. Опасность их появления может существенно возрастать у больных, которые регулярно и в течение длительного времени принимают высокие дозы НПВП. Кардиоваскулярные осложнения связываются с прокоагулянтным действием этих препаратов, которое возникает вследствие нарушения равновесия между синтезом тромбоксана А2 (ЦОГ–1 зависимый процесс) и простациклина (ЦОГ–2 зависимый процесс) [1].
Парентеральное применение
или пероральный прием?
Многие врачи считают, что при парентеральном применении НПВП оказывают более мощное анальгетическое действие в сравнении с использованием стандартных таблетированных форм. Конечно, не вызывает сомнения, что внутривенное введение НПВП, обеспечивающее достижение пиковой концентрации лекарства в плазме крови в первые же минуты, оказывает максимально быстрый терапевтический эффект. Но к подобному способу применения НПВП врачи терапевтических специальностей прибегают достаточно редко. К тому же лишь немногие представители группы НПВП, имеющиеся на российском фармакологическом рынке в виде растворов для парентерального применения, разрешены для внутривенного введения. Зато повсеместной практикой в нашей стране является назначение НПВП в виде внутримышечных инъекций, причем нередко курсами, существенно превышающими предписанные компаниями–производителями сроки использования такой лекарственной формы. Оправданием подобной практики является представление не только о большей эффективности, но и лучшей переносимости этих препаратов при парентеральном применении («не раздражает желудок»).
Однако это представление не выдерживает серьезной критики. Выраженность эффекта любого лекарства зависит от его концентрации в плазме крови, независимо от того фармакологического пути, с помощью которого он попал в человеческий организм. Высокая (практически 100%–ная) биодоступность современных пероральных форм НПВП обеспечивает стабильную терапевтическую концентрацию действующего вещества в плазме, которая определяется, соответственно, лишь назначенной дозой. Поэтому, если больной получает НПВП в течение нескольких дней регулярно и с учетом времени «полужизни» лекарства (т.е., соблюдая предписанную кратность приема), его эффективность будет идентичной при использовании любых фармакологических форм.
Таким образом, если больной получает НПВП регулярно более одного дня, то имеет смысл ограничиться лишь 1–2 внутримышечными инъекциями, преимущество которых, в сравнении с таблетками и капсулами, может определяться лишь более быстрым наступлением анальгетического действия.
Хотя и этот пункт вызывает серьезные сомнения. Современные таблетированные формы НПВП обеспечивают не только максимальную биодоступность, но и минимальное время всасывания действующего вещества. Так, целекоксиб 200–400 мг после перорального приема уже через 30 минут обнаруживается в плазме в концентрации 25–50% от максимальной и начинает оказывать анальгетическое действие. Эти данные получены не только в экспериментальных работах, но и серьезным опытом применения этого препарата для купирования острой боли – в частности, в стоматологической практике [3,4].
Имеются немало исследований, в которых проводилось сравнение эффективности НПВП при пероральном и внутримышечном применении. Так, в исследовании, проведенном на добровольцах, лорноксикам в виде быстрорастворимых таблеток демонстрировал показатели Tmax и Cmax, аналогичные внутримышечному введению этого препарата [5]. Быстродействие рапидных таблетированных форм, вполне сопоставимое с внутримышечным введением, было показано для ибупрофена, диклофенака калия и кеторолака [6–9].
Отсутствие реальных преимуществ внутримышечного введения НПВП весьма наглядно демонстрирует работа Neighbor M. и Puntillo K. (1998). Авторы сравнили анальгетический потенциал кеторолака 60 мг внутримышечно и ибупрофена 800 мг перорально у 119 больных с острой болью, поступивших в отделение неотложной терапии. Для соблюдения стандарта «двойного слепого исследования» больным, получавшим инъекции НПВП, давалась капсула плацебо per os, а получавшим НПВП перорально проводилась инъекция плацебо (физ. р–р). Уровень обезболивания оценивался через 15, 30, 45, 60, 90 и 120 мин. Согласно полученным результатам, достоверной разницы ни по скорости наступления анальгетического эффекта, ни по выраженности облегчения боли между исследуемыми группами выявлено не было (!) [10].
Отдельным вопросом является применение НПВП в виде ректальных суппозиториев. Имеются данные, что такой путь введения НПВП дает столь же быстрый анальгетический эффект, как и внутримышечное введение. Теоретически ректальное (как и парентеральное) введение НПВП позволяет избежать начального снижения концентрации препарата в крови из–за элиминации его значимого количества печенью (феномен «первого прохождения»). Тем не менее четких доказательств в отношении преимущества ректальных свечей по скорости наступления и выраженности терапевтического действия в сравнении с формами для приема внутрь, до настоящего времени не получено [11–13].
Мнение, что ректальные свечи переносятся лучше и реже вызывают побочные эффекты со стороны верхних отделов ЖКТ, оправдано лишь отчасти и касается несколько меньшей частоты развития диспепсии. Серьезные осложнения – такие как развитие язвы или ЖКТ–кровотечения, при использовании НПВП в виде ректальных свечей возникают не менее часто, чем при пероральном приеме [14]. По нашим данным, частота язв и множественных эрозий у больных, принимавших НПВП в виде свечей (n=343), составила 22,7%, в то время как у больных (n=3574), принимавших НПВП перорально – 18,1% (p<0,05). Причина этого совершенно очевидна – поражение верхних отделов ЖКТ связано с системным влиянием НПВП на слизистую оболочку ЖКТ, развивающимся после попадания этих препаратов в плазму крови, и вследствие этого абсолютно не зависит от фармакологического пути [15].
С другой стороны, ректальное введение НПВП может в ряде случаев приводить к тяжелым локальным осложнениям со стороны дистальных отделов кишечной трубки – клинически выраженному проктиту, изъязвлению слизистой прямой кишки и ректальному кровотечению [16–18].
Поэтому основным показанием для использования НПВП в виде ректальных суппозиториев является невозможность перорального приема этих препаратов и наличие особого пристрастия больных к данной фармакологической форме.
Длительность приема и дозы
Многие эксперты, говоря о применении этого класса лекарственных препаратов, делают особый упор на необходимости предупреждения осложнений. При этом часто используется рекомендация: «Использовать НПВП в наименьших эффективных дозах в течение минимального времени». Однако хотелось бы предостеречь врачей от волевого ограничения длительности использования анальгетических средств. Следует помнить, что боль – наиболее тягостный симптом, и недостаточно эффективная обезболивающая терапия (в т.ч. в той ситуации, когда врач отказывается от применения НПВП из опасения развития осложнений) крайне неблагоприятно сказывается на отношении больного к терапии в целом и может серьезно подорвать доверие к лечащему врачу.
Как показывает опыт, пациенты, испытывающие боль, зачастую прибегают к самолечению и активно используют безрецептурные анальгетики. Однако бесконтрольный и длительный прием подобных средств (в нашей стране существенную часть из них составляют метамизолсодержащие препараты) чреват серьезными осложнениями. Нередко больные самостоятельно начинают использовать «рецептурные» НПВП – к сожалению, легкодоступные в нашей стране, – подбирая препарат, дозу и кратность приема по своему усмотрению или по советам своих друзей и родственников. Более того, популярная риторика о «небезопасных и малоэффективных лекарственных препаратах» широко используется фирмами, занимающимися продажей БАД и предоставлением малообоснованных, с точки зрения современной науки, медицинских услуг. Недостаточно активная анальгетическая терапия нередко толкает пациентов, неудовлетворенных официальной медициной, к подобным «целителям» – путь, печальные последствия которого при серьезных ревматических заболеваниях хорошо известны. Таким образом, ограничение эффективной обезболивающей терапии из–за опасения развития лекарственных осложнений может приводить к более серьезным проблемам, чем сами лекарственные осложнения.
Если доктор считает, что при наличии соответствующих показаний (умеренной или выраженной боли, связанной с тканевым повреждением или воспалением) использование НПВП невозможно или должно быть ограничено коротким курсом в связи с очень высоким риском осложнений (см. ниже), следует продумать альтернативные возможности адекватного обезболивания.
Такими методами может стать применение парацетамола (при слабой боли) или мягкого опиоидного препарата трамадола (при выраженной боли). Однако парацетамол и трамадол, даже в максимальных дозах, уступают НПВП по своей эффективности, особенно при длительном применении.
Так, по результатам двух однотипных 6–недельных исследований VACT–1 и VACT–2 (суммарно 1578 больных остеоартрозом (ОА)) было показано, что целекоксиб в дозе 200 мг/сут. значительно превосходит парацетамол в дозе 4 г/сут. по своему анальгетическому действию. При этом число отмен терапии вследствие побочных эффектов на фоне приема целекоксиба было достоверно меньше в сравнении с препаратами сравнения – рофекоксибом и парацетамолом – соответственно, 2,5, 6,3 и 7,8% (р=0,001) [19]. Преимущества НПВП перед парацетамолом наиболее четко было доказано в работе Pincus T. и сотр., представляющей собой два однотипных перекрестных 12–недельных РКИ PACES–a (n=524) и PACES–b (n=556). В ходе исследований проводилось сравнение терапевтического потенциала целекоксиба 200 мг и парацетамола 4 г/сут. (а также плацебо) у больных с ОА крупных суставов. Суммарная эффективность целекоксиба, оцененная по динамике индекса WOMAC, была примерно на 40% выше, чем у парацетамола (р<0,05). При этом пациенты значительно чаще отдавали предпочтение целекоксибу по сравнению с парацетамолом – 53% vs 24% (p<0,001) в PACES–a и 50% vs 32% (p=0,009) в PACES–b [20].
Преимущество НПВП над трамадолом при лечении хронической боли было показано в работе O’Donnell J. и сотр. В этом исследовании изучалась сравнительная эффективность и переносимость целекоксиба 400 мг и трамадола 200 мг/сут. у 791 пациента с хронической (не менее 3 месяцев) болью в нижней части спины. Через 6 недель наблюдения 63,2% больных, получавших НПВП, отметили существенное улучшение своего состояния («удовлетворенность терапией»), в то время как получавшие трамадол – лишь 49,9% (p<0,001). Принципиально важно, что побочные эффекты, преимущественно со стороны центральной нервной системы, в 4 раза чаще отмечались на фоне приема опиоидного препарата – так, число отмен лечения из–за осложнений терапии в исследуемых группах составило 4,5 и 18,5% (p<0,001) [21]
Важнейший принцип проведения анальгетической терапии заключается в том, что лечение боли должно продолжаться столько времени, сколько требуется для ее максимально полного купирования. При этом следует оперировать эффективными дозами препаратов. Для НПВП это, несомненно, средние и высокие дозы, обеспечивающие не только анальгетическое, но и противовоспалительное действие.
Данное положение подтверждает исследование, проведенное Greenwald M. и сотр. (2009). В этой работе исследуемую группу составил 761 больной с ревматоидным артритом, из них 178 получали комплексную терапию с использованием биологических препаратов (этанерсепт, анакира, адалимумаб, натализумаб, инфликсимаб и абатасепт). Авторы оценивали терапевтическое действие одного из представителей группы «коксибов» – эторикоксиба, который назначался в эффективной противовоспалительной дозе (90 мг) или в меньшей дозировке (10–60 мг) сроком на 12 недель. Контроль составляли пациенты, получавшие плацебо. Согласно полученным результатам, независимо от использования биологических препаратов, самый убедительный результат в плане улучшения состояния пациентов был достигнут на фоне непрерывного приема высокой дозы НПВП. Так, в отличие от группы плацебо, в этой группе средняя динамика боли (по ВАШ) составила для получавших биологические препараты –12,9 мм, а для не получавших –15,5 мм соответственно. В другой группе, где НПВП использовались в меньшей дозировке, отличие от плацебо оказалось гораздо менее выраженным: –6,7 и –5,5 мм соответственно. Более того, на фоне приема высокой дозы эторикоксиба, независимо от биологической терапии, отмечалось четкое снижение числа припухших суставов – показатель, отражающий в большей степени противовоспалительное действие НПВП [22].
Во всех исследованиях, показавших высокий терапевтический потенциал НПВП, эти лекарства использовались длительно, непрерывно и в действенной дозировке. Именно такой метод применения НПВП является целесообразным для достижения максимального терапевтического успеха при воспалительных ревматических заболеваниях, таких как ревматоидный артрит и болезнь Бехтерева [1].
При последнем заболевании применение высоких доз НПВП прямо показано как один из наиболее действенных методов противоревматической терапии [23]. Более того, есть данные, показывающие, что непрерывный прием НПВП при анкилозирующем спондилите (АС) оказывает не только симптоматическое, но и патогенетическое действие. Речь идет о знаменитом исследовании Wanders A. и сотр., в ходе которого 215 больных достоверным АС в течение 2 лет получали или целекоксиб в дозе 200–400 мг ежедневно, или НПВП в режиме «по требованию». Основной конечной точкой исследования являлась бальная оценка рентгенологического прогрессирования в шейном и поясничном отделах позвоночника. Оказалось, что постоянный прием целекоксиба достоверно замедлил развитие поражения позвоночника, составившее 0,4±1,7 vs 1,5±2,5 балла (р=0,002) [24].
Однако не только при воспалительных, но и при дегенеративных заболеваниях суставов, таких как ОА, длительное применение НПВП может быть более эффективным, чем кратковременное использование этих препаратов. Ведь хорошо известно, что прогрессирование ОА четко связано с наличием суставного воспаления. Хотя этот процесс часто протекает субклинически, тем не менее это классическое воспаление, при котором отмечается активация лимфогистиоцитарных клеток с локальным выбросом провоспалительных цитокинов – интерлейкина (ИЛ) 1 и 6, фактора некроза опухоли (ФНО), гиперэкспрессией циклооксигеназы–2 (ЦОГ–2), повышением синтеза провоспалительных простагландинов и выбросом тканевых протеаз (металлопротеиназ) [25].
Яркой иллюстрацией преимущества постоянного приема НПВП при ОА стала работа Dougados M. и сотр. (2009). В ходе многоцентрового РКИ 858 пациентов с ОА коленных и/или тазобедренных суставов, в течение 22 недель получали целекоксиб 200 мг/сут. или постоянно (независимо от клиники), или в интерметирующем режиме (только при появлении болей). Следует отметить, что существенная часть больных имели сопутствующие кардиоваскулярные заболевания – так, 45% страдали артериальной гипертензией, а 20% постоянно принимали низкие дозы ацетилсалициловой кислоты (АСК) в связи с наличием риска развития сосудистого тромбоза. Полученные результаты четко показали преимущества постоянного приема целекоксиба. Лица, получавшие такую терапию, имели на 42% меньше эпизодов обострений заболевания, в сравнении с группой контроля: в среднем, 0,54 и 0,93 за каждый месяц наблюдения (р<0,001). Продолжительность обострений ОА также была меньше у больных, получавших целекоксиб постоянно – соответственно, 6,6±8,6 и 9,8±9,3 дня (р<0,001). Важным моментом, подтверждающим эффективность первой схемы применения НПВП, стала достоверно меньшая (примерно в 1,5 раза) потребность в дополнительном анальгетике, в роли которого традиционно выступал парацетамол.
При этом, несмотря на серьезный коморбидный фон, не было достоверной разницы по частоте любых побочных эффектов, которые суммарно отмечались у 56,8 и 58,8% больных. Серьезные лекарственные осложнения были отмечены у 1,4 и 2,3% соответственно. В частности, дестабилизация артериальной гипертензии отмечалась у 11,8 и 10,5% пациентов [26].
Выбор НПВП с учетом наличия
факторов риска лекарственных осложнений
На сегодняшний день следует считать аксиомой следующее положение, касающееся использования НПВП в реальной клинической практике: все препараты этой группы в адекватных терапевтических дозах эквивалентны по своему обезболивающему, противовоспалительному и жаропонижающему действию, но могут существенно отличаться по своей переносимости и риску развития серьезных лекарственных осложнений.
Таким образом, важнейший критерий выбора НПВП – безопасность. В первую очередь, она должна оцениваться по риску развития НПВП–гастропатии, кардиоваскулярных осложнений и частоте диспепсии. Первые два параметра (серьезные осложнения со стороны ЖКТ и сердечно–сосудистой системы) имеют принципиальное значение, поскольку они отражают основные «класс–специфические» осложнения, свойственные всем НПВП и составляющие реальную угрозу жизни больных [1,2]. Диспепсия не является прямо жизнеугрожающим осложнением; тем не менее неприятные симптомы со стороны верхних отделов ЖКТ – наиболее частое проявление негативного действия НПВП на человеческий организм. Именно диспепсия зачастую становится основным субъективным критерием переносимости НПВП для больных и также является наиболее распространенной причиной прерывания лечения [1,27].
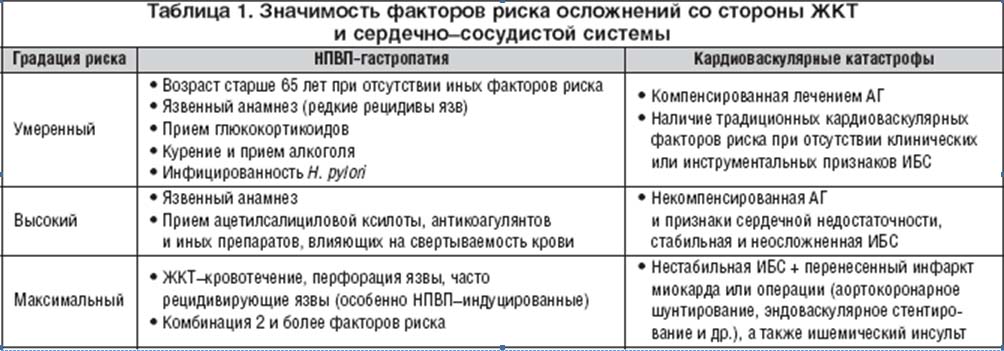
Серьезные НПВП–ассоциированные осложнения со стороны ЖКТ и сердечно–сосудистой системы являются патологией, которую можно прогнозировать и успешно предотвратить. Хорошо известно, что подавляющее большинство угрожающих жизни осложнений возникает у лиц, имеющих «факторы риска», для которых была предложена соответствующая градация по степени значимости (табл. 1) [1].
Соответственно, основным методом, позволяющим обеспечить максимально безопасное использование НПВП, является четкая оценка вероятности осложнений и назначение наиболее безопасных препаратов. При этом представление о безопасности того или иного лекарства должно быть основано на серьезных доказательствах, полученных в ходе хорошо организованных клинических испытаний, а также ретроспективного анализа его применения в реальной клинической практике. Подобная оценка осуществляется с помощью рандомизированных контролируемых исследований (РКИ), а также длительного наблюдения больших когорт больных и эпидемиологических работ, в которых оценивается риск тех или иных осложнений («случай–контроль»).
Так, на сегодняшний день мы можем говорить о том, что среди неселективных НПВП (н–НПВП) наименьший риск развития ЖКТ–осложнений показан для диклофенака, ибупрофена и ацеклофенака [1]. Причем последний из них демонстрирует наилучшую суммарную переносимость, поскольку достоверно реже вызывает диспепсию. Подтверждением этого является, например, масштабное британское 12–месячное исследование SAMM, где ацеклофенак в дозе 200 мг/сут. сравнивался с диклофенаком 150 мг/сут.: на фоне приема последнего неприятные ощущения со стороны ЖКТ возникали в 1,5 раза чаще [28].
Серия эпидемиологических исследований, проведенных в европейских странах, четко показывает, что максимальный риск опасных ЖКТ–осложнений отмечается на фоне приема таких н–НПВП, как индометацин, пироксикам и кетопрофен (примерно в 1,5–3 раза выше в сравнении с диклофенаком). Наиболее высокий риск осложнений показан для кеторолака, поэтому этот препарат может использоваться лишь как средство для ургентного обезболивания (не более 3–5 дней) [29–36].
Основываясь на результатах нескольких популяционных работ, проведенных в Италии и Испании, можно утверждать, что ацеклофенак вызывает ЖКТ–кровотечения существенно реже по сравнению с другими н–НПВП, такими как диклофенак и ибупрофен [33,34]. Впрочем, пока это не подтверждается данными проспективных исследований.
В отношении кардиоваскулярного риска, наименьший риск среди всех н–НПВП (да и вообще среди всех НПВП) показан для напроксена. Ряд крупных популяционных исследований и соответствующий мета–анализ – например, масштабная работа McGettigan P. и Henry D., включавшая оценку 17 исследований случай–контроль: 86193 больных с инфарктом миокарда и 527236 контроль и 6 когортных исследований: с–НПВП 75520, н–НПВП 375619, 594720 контроль, подтверждают, что этот препарат фактически не повышает опасность развития инфаркта миокарда. К сожалению, применение этого достойного лекарства сопровождается существенным повышением риска ЖКТ–кровотечений: по риску развития этой патологии он занимает промежуточную позицию между диклофенаком и кетопрофеном [37].
Эпидемиологические исследования также четко показывают, что кетопрофен и ибупрофен в меньшей степени повышают риск развития инфаркта миокарда и ишемического инсульта, в сравнении с диклофенаком. Определенных данных в отношении ацеклофенака, позволяющих судить о реальном риске развития кардиоваскулярных катастроф при использовании этого препарата, в настоящее время еще не получено [37].
Нимесулид и мелоксикам, которые в нашей стране относятся к числу селективных НПВП (с–НПВП) и весьма популярны, в отношении риска развития патологии ЖКТ считаются более безопасными в сравнении с н–НПВП [1,2].
Несколько европейских и российских исследований определенно показывают снижение суммарной частоты побочных эффектов (прежде всего за счет диспепсии), у больных, получавших нимесулид, в сравнении с н–НПВП [1,2]. Кроме того, по результатам нескольких эпидемиологических работ (по типу «случай–контроль»), проведенных в Италии и Испании, можно судить о довольно низком относительном риске ЖКТ–кровотечений при использовании этого препарата [35,36]. К сожалению, неоспоримых доказательств большей безопасности нимесулида, в сравнении с такими представителями н–НПВП, как диклофенак и ибупрофен, полученных в ходе хорошо организованных РКИ и соответствующего мета–анализа, к сожалению, до настоящего времени не получено.
Значительно больше доказательная база безопасности мелоксикама в дозе 7,5 мг. Об этом мы можем судить по данным двух масштабных 4–недельных РКИ (суммарно более 16 тыс. больных) – MELISSA и SELECT [38,39]. Так, общая частота ЖКТ–осложнений в РКИ MELISSA на фоне приема мелоксикама составила 13,3%, а диклофенака – 18,7% (p<0,001). Однако длительные исследования, в которых изучалась безопасность более высоких доз мелоксикама – 15 и 22,5 мг/сут., не позволили выявить существенных различий в частоте опасных ЖКТ–осложнений между этим препаратом и диклофенаком [40,41]. Это четко показывают результаты мета–анализа 28 РКИ (n=24.196), в которых мелоксикам сравнивался с н–НПВП: частота ЖКТ–кровотечений при использовании дозы 7,5 мг/сут. составила 0,03%, а 15 мг – уже 0,2%, в то время как на фоне приема диклофенака 100–150 мг/сут. – 0,15% [42].
Масштабные европейские популяционные исследования также не подтверждают, что риск развития серьезных ЖКТ–осложнений при использовании мелоксикама значимо ниже, в сравнении с н–НПВП [33,34].
Реальный уровень ЖКТ–безопасности мелоксикама можно определить при сопоставлении с другим популярным представителем группы с–НПВП – целекоксибом. Такое сравнение было проведено британскими учеными, изучавшими частоту клинически значимых ЖКТ–осложнений на фоне мелоксикама (19111 больных, 1996–1997 гг.) и целекоксиба (17567 больных, 2000 г.) в реальной клинической практике. Согласно полученным данным, любые осложнения со стороны ЖКТ были отмечены у 7,2% больных, получавших мелоксикам, и у 6,0% больных, принимавших целекоксиб, причем кровотечения и перфорации язв возникли в 2 раза чаще – у 0,4 и 0,2% [43]. Приняв за 1,0 риск развития ЖКТ–кровотечения на фоне приема н–НПВП, после пересчета данных с учетом наличия факторов риска (с–НПВП чаще назначались у больных с высоким риском), снижение аналогичного риска при использовании мелоксикама составило 14%, а для целекоксиба – 62% [44].
Уровень кардиоваскулярного риска при использовании мелоксикама можно оценить по результатам эпидемиологических исследований, проведенных в США (Singh G. и сотр., 15 343 больных с ИМ, 61 372 – контроль) и Финляндии (Helin–Salmivaara A., и сотр., 33 309 больных с ИМ, 138 949 – контроль). Мелоксикам демонстрировал несколько более высокий риск развития ИМ в сравнении с целекоксибом, мелоксикамом и кетопрофеном [45,46]. Аналогичные результаты показал мета–анализ McGettigan P. и Henry D.: относительный риск ИМ для целекоксиба составил 1,06, для мелоксикама – 1,25 [37].
Оценка кардиоваскулярного риска, связанного с приемом для нимесулида, по всей видимости, может быть ограничена лишь цитированной выше работой Helin–Salmivaara A. и сотр. Нимесулид демонстрировал частоту ИМ, близкую другим НПВП (ОР 1,69), и несколько уступал в этом плане целекоксибу (ОР 1,06) [46].
Важным достоинством мелоксикама и нимесулида, как и иных с–НПВП, является минимальная частота респираторных осложнений и возможность достаточно безопасного применения у больных с т.н. «аспирин–ассоциированным респираторным заболеванием». Кроме того, мелоксикам отчетливо выделяется среди других НПВП минимальным риском развития кожных аллергических реакций [47,48].
На сегодняшний день явное снижение риска развития патологии ЖКТ, при сопоставлении с н–НПВП, не вызывает сомнения лишь при использовании целекоксиба и эторикоксиба. Так, для первого из них доказательства снижения риска кровотечения, перфорации и развития язв желудка и/или ДПК основывается на данных масштабных и длительных РКИ – CLASS и SUCCESS–1 [49,50]. В соответствии с результатами мета–анализа 31 РКИ, в которых изучалась безопасность этого препарата (n=39605), суммарная частота опасных осложнений при использовании целекоксиба составила 0,4%, а на фоне приема н–НПВП – 0,9% [51].
Ценным доказательством преимущества целекоксиба в сравнении с диклофенаком и ибупрофеном является значительно меньшая частота эндоскопических язв, возникающих на фоне приема этих препаратов. Подтверждением этого стала серия хорошо организованных и длительных РКИ, где все пациенты до– и после курсового приема НПВП проходили эндоскопическое исследование. На фоне приема целекоксиба язвы желудка и/или ДПК возникали в 3–4 раза реже, чем при использовании диклофенака, напроксена и ибупрофена [52–54].
Предметом пристального изучения ученых стала кардиоваскулярная безопасность целекоксиба. По данным мета–анализа наиболее важных РКИ, в которых целекоксиб в дозе от 200 до 800 мг/сут. применялся для лечения боли, связанной с ревматологической патологией (n=19773), риск развития опасных побочных эффектов со стороны сердечно–сосудистой системы не превышал аналогичный для н–НПВП (n=13990). Суммарно кардиоваскулярные осложнения были отмечены у 0,96 и 1,12% больных, из них острая коронарная смерть у 0,21 и 0,41%, ИМ у 0,57 и 0,34%, а ишемический инсульт у 0,18 и 0,34% [55].
Масштабные эпидемиологические исследования также подтверждают относительно низкий риск развития кардиоваскулярных катастроф при использовании целекоксиба (соответствует аналогичному риску для напроксена, ибупрофена и кетопрофена) [37,45,46].
Важным достоинством целекоксиба, выделяющим его среди всех НПВП, является большой опыт оценки его безопасности у пациентов, которые имеют факторы риска.
Так, в двух масштабных исследованиях было показано, что на фоне приема целекоксиба рецидивы язв верхних отделов ЖКТ и ЖКТ–кровотечений возникают несколько (недостоверно) реже, в сравнении с использованием комбинации н–НПВП и мощного гастропротектора (диклофенак + омепразол и напроксен + лансопразол) [56,57]. В том случае, когда опасность серьезных осложнений со стороны ЖКТ очень высок (табл. 1), целесообразно использовать комбинацию целекоксиба и гастропротектора. В этом случае риск развития угрожающих жизни ЖКТ–осложнений снижается до минимума, как было показано в работе Chan F. и сотр. (2007). В ходе исследования 441 больной, перенесший язвенное кровотечение и прошедший успешный курс противоязвенного лечения, в течение 12 мес. получали целекоксиб 400 мг или целекоксиб 400 мг в комбинации с эзомепразолом 20 мг. За время наблюдения в группе больных, получавших целекоксиб + эзомепразол, не возникло ни одного эпизода рецидива осложненных язв. В контрольной группе за время наблюдения возникло 12 эпизодов ЖКТ–кровотечений (8,9%), p<0,001 [58].
Другим фактором риска НПВП–гастропатии – вторым по степени значимости после язвенного анамнеза – является прием препаратов, влияющих на свертывающую систему крови. Goldstein J. и сотр. провели сравнительную оценку риска развития НПВП–гастропатии на фоне приема целекоксиба в комбинации с АСК. Согласно плану исследования, 662 добровольца, у которых при проведении эндоскопического исследования исходно не было выявлено патологии верхних отделов ЖКТ, на 7 дней была назначена АСК 81 мг в сочетании с целекоксибом 200 мг/сут., напроксеном 1000 мг или плацебо. При повторном эндоскопическом исследовании суммарная частота язв желудка и 12–перстной кишки на фоне приема целекоксиба оказалась более чем в 3 раза меньше, чем при использовании напроксена – 7 и 25,5% (р<0,001) [59].
Более низкий риск развития серьезных ЖКТ–осложнений при комбинации целекоксиба и низких доз АСК в сравнении с н–НПВП был показан по результатам масштабного популяционного исследования, проведенного в Канаде [60].
Большое значение для оценки кардиоваскулярной безопасности НПВП имеет риск дестабилизации артериальной гипертензии (АГ). С одной стороны, артериальное давление (АД) легко поддается инструментальному контролю и поэтому может считаться весьма удобным показателем негативного влияния НПВП на сердечносо–судистую систему. С другой стороны, АГ является одним из наиболее важных факторов риска кардиоваскулярных катастроф [1,2].
В этом плане большой интерес представляет работа White W. и сотр., в которой сравнивалось влияние целекоксиба 400 мг/сут. и плацебо на уровень АД (по данным суточного мониторирования АД, СМАД). Исследуемую группу составили больные, получавшие эффективную антигипертензивную терапию (лизиноприл 10–40 мг/сут.). Через 4 недели наблюдения не было отмечено достоверной отрицательной динамики АД как в основной, так и контрольных группах: изменение САД в среднем составило 2,6±0,9 и 1,0±1,0, а ДАД 1,5±0,6 и 0,3±0,6 мм рт.ст. соответственно. При этом соотношение больных, у которых при контрольном СМАД отмечалось повышение АД в среднем более 5 мм рт.ст., оказалось одинаковым [61].
Чрезвычайно важны результаты РКИ CRESCENT, в котором оценивалось влияние целекоксиба на АД у больных с высоким кардиоваскулярным риском. В работу были включены 411 пациентов с остеоартрозом и сахарным диабетом 2–го типа, имевших контролируемую АГ. Согласно плану исследования, они в течение 6 недель принимали целекоксиб 200 мг, рофекоксиб 25 мг или напроксен 1000 мг/сут. Дестабилизация АГ (среднее повышение САД выше 135 мм рт.ст.) на фоне приема целекоксиба была отмечена у 16% больных, в то время как на фоне приема напроксена у 19%, а рофекоксиба – 30% [81]. Таким образом, целекоксиб влиял на АД даже в меньшей степени, чем общепризнанный стандарт кардиоваскулярной безопасности напроксен [62].
Реальная клиническая практика также подтверждает благоприятный профиль кардиоваскулярной переносимости целекоксиба. Так, Mamdani M. и сотр. в ходе популяционного исследования оценили риск развития или дестабилизации сердечной недостаточности на фоне приема целекоксиба и иных НПВП. Согласно результатам этой работы, риск госпитализации по поводу кардиоваскулярной патологии у 18908 больных, получавших целекоксиб, не отличался от аналогичного риска у 100 тыс. лиц, выступавших в качестве контроля (не использовавших какие–либо НПВП). В то же время у 5391 больного, получавшего н–НПВП, и 14583 больных, принимавших рофекоксиб, риск был повышен на 40 и 80% (ОР 1,4 и 1,8 соответственно) [63].
Целекоксиб, таким образом, имеет четкие доказательства более низкого риска развития ЖКТ–осложнений и кардиоваскулярных катастроф, в сравнении с иными НПВП, в т.ч. и у пациентов, имеющих повышенный риск лекарственных осложнений. Поэтому этот препарат является средством выбора для проведения кратковременной и длительной терапии боли у пациентов, имеющих факторы риска ЖКТ и кардиоваскулярных осложнений.
Несомненно, нельзя забывать и о методах медикаментозной профилактики лекарственных осложнений. Применение эффективных гастропротекторов (ингибиторов протонной помпы, ИПП) позволяет существенно снизить риск развития ЖКТ–кровотечения, развития и рецидивов язв верхних отделов ЖКТ, а также выраженность диспепсии. При этом комбинация с–НПВП + ИПП является более безопасной, нежели комбинация н–НПВП + ИПП. Это подтверждают результаты идентичных по дизайну 6–месячных РКИ VENUS и PLUTO (n=1378). Согласно полученным результатам, у больных, получавших эзомепразол 20 и 40 мг, на фоне приема н–НПВП отмечалось появление язв у 7 и 5% больных соответственно, в то время как у получавших с–НПВП – лишь 1 и 4% (p<0,05) [64].
Использование низких доз АСК рассматривается как действенное средство для профилактики тромбоэмболических осложнений на фоне приема НПВП, которое следует использовать у всех больных, имеющих существенное повышение кардиоваскулярного риска [65]. Так, по данным популяционного исследования Singh G. и сотр. (всего 2356885 пациентов/лет, 15343 эпизода ИМ), комбинированное применение НПВП и низких доз АСК снижало риск развития кардиоваскулярных катастроф на 20–30%. Так, если у больных, получавших целекоксиб, риск (ОР) развития без АСК составил 1,12, то при комбинации – 0,88. Важным исключением здесь является ибупрофен, который снижает антитромботическое действие АСК и поэтому не должен с ней сочетаться. В работе Singh G. ОР инфаркта миокарда у принимавших ибупрофен без и с АСК составил 1,08 и 1,2 [66].
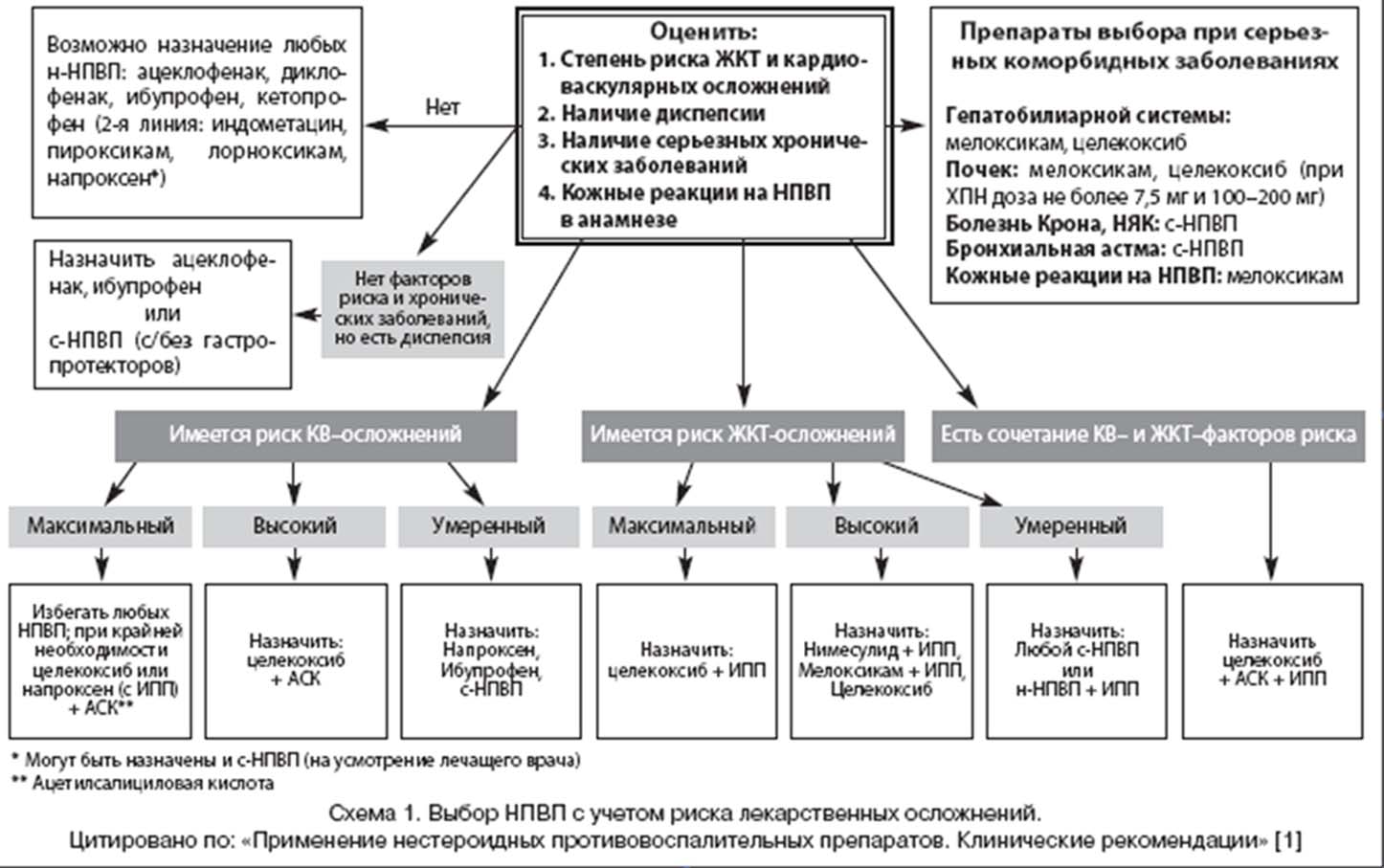
Суммируя вышесказанное, мы можем сказать, что на сегодняшний день оптимальный выбор НПВП, как и методов медикаментозной профилактики, в зависимости от наличия или отсутствия факторов риска лекарственных осложнений основывается на четких критериях и может быть успешно осуществлен с использованием схемы 1.
Литература
1. Каратеев А.Е., Яхно Н.Н., Лазебник Л.Б. и др. Применение нестероидных противовоспалительных препаратов. Клинические рекомендации. Москва, ИМА–ПРЕСС, 2009, 167 с.
2. Насонов Е.Л., Лазебник Л.Б., Беленков Ю.Н. и сотр. Применение нестероидным противовоспалительных препаратов. Клинические рекомендации. Москва, «Алмаз», 2006, 88 с.
3. Malmstrom K., Fricke J., Kotey P., et al. A comparison of rofecoxib versus celecoxib in treating pain after dental surgery: a single–center, randomized, double–blind, placebo– and active–comparator–controlled, parallel–group, single–dose study using the dental impaction pain model. Clin Ther. 2002,24(10):1549–1560.
4. Cheung R., Krishnaswami S., Kowalski K. Analgesic efficacy of celecoxib in postoperative oral surgery pain: a single–dose, two–center, randomized, double–blind, active– and placebo–controlled study. Clin Ther. 2007; 29, Suppl: 2498–2510.
5. Radhofer–Welte S., Dittrich P., Simin M., Branebjerg P. Comparative bioavailability of lornoxicam as single doses of quick–release tablet, standard tablet and intramuscular injection: a randomized, open–label, crossover phase I study in healthy volunteers. Clin Drug Investig. 2008;28(6):345–351.
6. Prado J., Daza R., Chumbes O., et al. Antipyretic efficacy and tolerability of oral ibuprofen, oral dipyrone and intramuscular dipyrone in children: a randomized controlled trial. Sao Paulo Med J. 2006, 124(3): 135–140.
7. Wright J., Price S., Watson W. NSAID use and efficacy in the emergency department: single doses of oral ibuprofen versus intramuscular ketorolac. Ann Pharmacother. 1994, 28(3): 309–312.
8. Brown C., Moodie J., Dickie G., et al. Analgesic efficacy and safety of single–dose oral and intramuscular ketorolac tromethamine for postoperative pain. Pharmacotherapy. 1990, 10, 59–70.
9. Moore N. Diclofenac potassium 12.5mg tablets for mild to moderate pain and fever: a re–view of its pharmacology, clinical efficacy and safety. Clin Drug Investig. 2007;27(3):163–195.
10. Neighbor M., Puntillo K. Intramuscular ketorolac vs oral ibuprofen in emergency department patients with acute pain. Acad Emerg Med. 1998,5(2): 92–93.
11. Davis M., Walsh D., LeGrand S., Naughton M. Symptom control in cancer patients: the clinical pharmacology and therapeutic role of suppositories and rectal suspensions. Support Care Cancer. 2002, 10(2): 117–138.
12. Kokki H., Tuomilehto H., Tuovinen K. Pain management after adenoidectomy with ketoprofen: comparison of rectal and intravenous routes. Br J Anaesth., 2000, 85(6): 836–840.
13. Pinto Pereira L., Chen D., Clement Y., Simeon D. Analgesic effects of diclofenac suppository and injection after preoperative administration. Int J Clin Pharmacol Res. 1999;19(2):47–51.
14. Mellemkjaer L., Blot W., Sorensen H., et al. Upper gastrointestinal bleeding among users of NSAIDs: a population–based cohort study in Denmark. Br J Clin Pharmacol., 2002, 53, 173–181.
15. Каратеев А.Е., Насонова В.А. Развитие и рецидивирование язв желудка и двенадцатиперстной кишки у больных, принимающих нестероидные противовоспалительные препараты: влияние стандартных факторов риска. Тер. Архив, 2008, 5, 62–66.
16. Gizzi G., Villani V., Brandi G., et al. Ano–rectal lesions in patients taking suppositories containing non–steroidal anti–inflammatory drugs (NSAID). Endoscopy. 1990, 22(3): 146–158.
17. Van Nieuwenhove K., Van Herreweghe I., Haentjens M., et al. Ulcers of the rectal mucosa caused by suppositories containing acetylsalicylic acid. J Pediatr Gastroenterol Nutr. 1997, 25(4): 430–431.
18. Arya N., Hawe M., Ozo C. Diclofenac suppositories and acute ischaemic proctitis. Ulster Med J. 2004, 73(1): 63–64.
19. Schnitzer T., Weaver A., Polis A. Efficacy of rofecoxib, celecoxib, and acetaminophen in patients with osteoarthritis of the knee. A combined analysis of the VACT studies. J. Rheumatol., 2005, 32, 1093–1105.
20. Pincus T., Koch G., Lei H., et al. Patient Preference for Placebo, Acetaminophen (paracetamol) or Celecoxib Efficacy Studies (PACES): two randomised, double blind, placebo controlled, crossover clinical trials in patients with knee or hip osteoarthritis. Ann. Rheum. Dis., 2004, 63, 931–939.
21. O’Donnell J., Ekman E., Spalding W., McCabe D. Analgesic effectiveness, tolerability, and safety of celecoxib versus tramadol in patients with chronic low back pain. ACR, 2007
22. Greenwald M., Peloso P., Hasler F. et al. Etoricoxib improves pain and function in rheumatoid arthritis patients on background biologic therapy. A&R, 2009, 60 (10), suppl.,606
23. Song I., Poddubnyy D., Rudwaleit M., Sieper J. Benefits and Risks of Ankylosing Spondylitis Treatment With Nonsteroidal Antiinflammatory Drugs. Arthritis & Rheum, 2008, 58 (4), 929–938
24. Wanders A., Heijde D., Landewe R., et al. Nonsteroidal antiinflammatory drugs reduce radiographic progression in patients with ankylosing spondylitis: a randomized clinical trial. Arthritis Rheum., 2005, 52, 1756–1765.
25. Bonnet C., Walsh D. Osteoarthritis, angiogenesis and inflammation. Rheumatology, 2005; 44(1):7—16.
26. Dougados M., Strand V., Simon L., Sands G., Bhadra P. Continuous versus intermittent celecoxib dosing in the treatment of osteoarthritis. ARD, 2009,
27. Каратеев А.Е., Насонов Е.Л., Корешков Г.Г. НПВП–индуцированная диспепсия: распространенность и возможность медикаментозной коррекции. Науч. Практ. Ревматол., 2003, 5, 76–78.
28. Hаskinsson E.C., Irani M., Murray F. A large prospective open–label, multi–centre SAMM study, comparing the safety of aceclofenac with diclofenac in patients with rheumatic disease. Eur.J.Rheumatol.Inflam., 2000,17, 1–7.
29. Henry D., Lim L., Garcia Rodriguez L. et al. Variability in risk of gastrointestinal complications with individual non–steroidal anti–inflammatory drugs: results of a collaborative meta–analysis. BMJ 1996; 312, 1563–1566.
30. Langman M., Weil J., Wainwright P., et al. Risk of bleeding peptic ulcer associated with individual non–steroidal anti–inflammatory drugs. Lancet 1994; 343: 1075–1078.
31. Perez Gutthann S., Garcia Rodriguez L., Raiford D. Individual NSAIDs and other risk factor for upper gastrointestinal bleeding and perforation. Epidemiology 1997, 8, 18–24.
32. Garcia Rodriguez L., Cattaruzzi C., Troncon M., Agostinis L. Risk of hospitalization for upper gastrointestinal tract bleeding associated with ketorolac, other NSAIDs, calcium antagonists, and other antihypertensive drugs. Arch Intern Med 1998, 158, 33–39.
33. Laporte J., Ibanez L., Vidal X., Vendrell L., Leone R. Upper gastrointestinal bleeding associated with the use of NSAIDs: newer versus older agents. Drug Safety 2004, 27, 411–420.
34. Lanas A., Garcia–Rodriguez L., Arroyo M., et al. Risk of upper gastrointestinal ulcer bleeding associated with selective cyclo–oxygenase–2 inhibitors, traditional non–aspirin non–steroidal anti–inflammatory drugs, aspirin and combinations. Gut. 2006, 55(12): 1731–738.
35. Pilotto A., Franceschi M., Leandro G., et al. The risk of upper gastrointestinal bleeding in elderly users of aspirin and other non–steroidal anti–inflammatory drugs: the role of gastroprotective drugs. Aging Clin Exp Res. 2003, 15(6): 494–499.
36. Menniti–Ippolito F., Maggini M., Raschetti R., et al. Ketorolac use in outpatients and gastrointestinal hospitalization: a comparision with other non–steroidal anti–inflammatory drugs in Italy. Eur. J. Clin. Pharmacol., 1998, 54, 393–397.
37. McGettigan P., Henry D. Cardiovascular risk and inhibition of cyclooxygenase. JAMA, 2006, 296, 1633–1644
38.. Hawkey C. et al. Gastrointestinal tolerability of meloxicam compared diclofenac in osteoarthritis patients. International MELISSA Study Group. Meloxicam Large–scale International Study Safety Assessment. Br J Rheumat 1998; 37: 1142–1147.
39. Dequerker J, Hawkey C, Kahan A, et al.. Improvement in gastrointestinal tolerability of selective cyclooxyenase (COX)–2 inhibitor, meloxicam, compared with piroxicam: results of the Safety and Efficacy Large Scale Evaluation of COX inhibiting Therapies (SELECT) trial in osteoarthritis. Br J Rheumatol 1998; 37: 946–951.
40. Yocum D., Fleischmann R., Dalgin P. Safety and efficacy of meloxicam in the treatment of osteoarthritis. Arch Intern Med 2000; 160: 2947–2954.
41. Furst D., Kolba K., Fleischmann R. Dose response and safety study of meloxicam up to 22.5 mg daily in rheumatoid arthritis: a 12 week multicenter, double blind, dose response study versus placebo and diclofenac. J. Rheumatol., 2002, 29, 436–446.
42. Singh G, Lanes S, Triadafilopoulos G. Risk of serious upper gastrointestinal and cardiovascular thromboembolic cpmplications with meloxicam. Am J Med 2004; 117: 100–106.
43. Layton D., Hughes K., Harris S., Shakir S. Comparison of the incidence rates of selected ga–strointestinal events reported for patients prescribed celecoxib and meloxicam in general practice in England using prescription–event monitoring (PEM) data. Rheumatology (Oxford). 2003, 42(11): 1332–1341.
44. MacDonald T., Morant S., Goldstein J., et al. Channelling bias and the incidence of gastrointestinal haemorrhage in users of meloxicam, coxibs, and older, non–specific non–steroidal anti–inflammatory drugs. Gut. 2003, 52(9): 1265–1270.
45. Singh G., Mithal A., Triadafilopoulos G. Both selective COX–2 inhibitors and non–selective NSAIDs increase the risk of acute myocardial infarction in patients with arthritis; selectivity is with patients, not the drug. Ann Rheum Dis 2005, 64 (suppl 3), 85
46. Helin–Salmivaara A., Virtanen A., Vesalainen R., et al. NSAID use and the risk of hospitalization for first myocardial infarction in the general population: a nationwide case–control study from Finland. Eur Heart J., 2006, 27(14), 1657–1663.
47. Senna G., Passalacqua G., Dama A., et al. Nimesulide and meloxicam are a safe alternative drugs for patients intolerant to nonsteroidal anti–inflammatory drugs. Eur Ann Allergy Clin Immunol. 2003, 35(10), 393–396.
48. La Grenade С., Lee L., Weaver J., et al. Comparison of reporting of Stevens–Johnson Syndrome and toxic epidermal necrosis in association with selective COX–2 inhibitors. Drugs Saf 2005; 28 (10): 917–924.
49. Silverstein F., Faich G., Goldstein J., et al. Gastrointestinal toxicity with celecoxib versus nonsteroidal anti–inflammatory drugs for osteoarthritis and rheumatoid arthritis: the CLASS study: a randomized controlled trial. Celecoxid long–term arthritis safety study. JAMA 2000; 84: 1247–1255
50. Singh G, Fort J, Goldstein J. et al. Celecoxib versus naproxen and diclofenac in osteoarthritis patients: SUCCESS–1 study. Am J Med 2006; 119: 255–266.
51. Moore R., Derry S., Makinson G., McQuay H. Tolerability and adverse events in clinical trials of celecoxib in osteoarthritis and rheumatoid arthritis: systemic review and meta–analysis on information from company clinical reports. Arthritis Res Ther 2005; 7: 644–665.
52. Simon L., Weaver A., Graham D. Anti–inflammatory and upper gastrointestinal effects of celecoxib in rheumatoid arthritis: a randomized control trial. JAMA 1999; 282;1921–1928.
53. Emery P., Zeidler H., Kvien T., et al. Celecoxib versus diclofenac in long–term management of rheumatoid arthritis: randomized double–blind comparison. Lancet 1999; 354: 2106–2111.
54. Hawkey C., Svoboda P., Fiedorowicz–Fabrycy I., et al. Gastroduodenal safety and tolerability of lumiracoxib compared with Ibuprofen and celecoxib in patients with osteoarthritis. J Rheumatol. 2004, 31(9): 1804–1810.
55. White W., West C., Borer J., et al. Risk of cardiovascular events in patients receiving celecoxib: a meta–analysis of randomized clinical trials. Am J Cardiol. 2007, 99(1): 91–98.
56. Chan F., Hung L., Suen B. et al. Celecoxib versus diclofenac and omeprasole in reducing the risk of recurrent ulcer bleeding in patients with arthritis. N Engl J Med 2002, 947, 2104–2110
57. Lai K., Chu K., Hui W. et al. Celecoxib compared with lansoprazole and naproxen to prevent gastrointestinal ulcer complications. Am J Med. 2005, 118(11), 1271–1278.
58. Chan F., Wong V., Suen B., et al. Combination of a cyclo–oxygenase–2 inhibitor and a proton–pump inhibitor for prevention of recurrent ulcer bleeding in patients at very high risk: a double–blind, randomised trial. Lancet, 2007, 369, 1621–1626.
59. Goldstein J., Aisenbeg J., Berger M., et al. Effects of concominant aspirin (81 mg) оn incidence the of gastric and/or duodenal ulcers in healthy subjects taking celecoxib or naproxen: a randomized placebo–controlled trial. Ann Rheum dis 2006; 65 (Suppl. II): 229 (TH0327 abst).
60. Rahme E., Bardou M., Dasgupta K., et al. Hospitalization for gastrointestinal bleeding associated with non–steroidal anti–inflammatory drugs among elderly patients using low–dose aspirin: a retrospective cohort study. Rheumatology (Oxford). 2007, 46(2): 265–272.
61. White W., Kent J., Taylor A., et al. Effects of celecoxib on ambulatory blood pressure in hypertensive patients on ACE inhibitors. Hypertension. 2002, 39(4): 929–934.
62. Sowers J., White W., Pitt B., et al. The Effects of cyclooxygenase–2 inhibitors and nonsteroidal anti–inflammatory therapy on 24–hour blood pressure in patients with hypertension, osteoarthritis, and type 2 diabetes mellitus. Arch Intern Med. 2005 Jan 24;165(2):161–168.
63. Mamdani M., Juuurkin D., Lee D., et al. Cyclo–oxygenase–2 inhibitors versus non–selective non–steroidal anti–inflammatory drugs and congestive heart failure outcomes in eldery patients: a population–based cohort study. Lancet 2004; 363: 1751–1756
64. Scheiman J., Yeomans N., Talley N., et al. Prevention of ulcer by esomeprazole in at–risk patients using non–selective NSAIDs or COX–2 inhibitor. Am. J. Gastroenterol., 2006, 101, 701–710.
65. Strand V. Are COX–2 inhibitors preferable to non–selective non–steroidal anti–inflammatory drugs in patients with risk of cardiovascular events taking low–dose aspirin? Lancet. 2007, 22; 370(9605), 2138–2151.
66. Singh G., Graham D., Wang H., et al. Concominant aspirin use reduces the risk of acute myocardial infarction in users of cyclooxygenase–2 selective and some non–selective non–steroidal anti–inflammatory drugs. Ann Rheum Dis 2006; 65 (Suppl. II): 61 (OP0024 abst)
Источник Русский Медицинский Журнал 11 сентября 2009 г, том 17, № 21













