Комбинированные симптоматические препараты замедленного действия в терапии остеоартроза
Алексеева Л.И., Шарапова Е.П.
Результаты исследований последних лет свидетельствуют о том, что остеоартроз (ОА) по-прежнему остается лидирующей причиной нетрудоспособности. Заболевание встречается примерно у 10% населения, а среди лиц старше 50 лет оно обнаруживается у каждого второго [1], поэтому в большинстве развитых стран ОА относят к основным проблемам здравоохранения. Кроме того, по прогнозам, его распространенность к 2020 году увеличится вдвое, частично за счет увеличения продолжительности жизни населения и нарастания частоты ожирения [2].
Несмотря на высокую распространенность ОА, этиопатогенез этого заболевания остается полностью не изученным. ОА представляет собой гетерогенную группу заболеваний, имеющих различную этиологию, но одинаковые биологические, морфологические и клинические исходы, при этом в патологический процесс вовлекаются суставной хрящ, субхондральная кость, синовиальная оболочка и периартикулярные ткани [3].
И хотя установлен самый главный признак ОА, а именно - деструкция суставного хряща, мы все еще до конца не понимаем, что является первопричиной разрушения хряща и последующей его потери. Полагают, что воспаление синовиальной оболочки играет важную роль в прогрессии суставного повреждения, однако, по общему мнению, это, скорее, вторичный феномен, зависящий от многих причин, включая деградацию хрящевого матрикса. Кроме того, процессы, происходящие в субхондральной кости, также являются частью общего патологического процесса [4]. Эти изменения ассоциируются с локальными нарушениями биохимических реакций, связанных с измененным метаболизмом остеобластов.
Длительное время лечение ОА было главным образом симптоматическим. На протяжении многих десятилетий список лекарственных средств, используемых для лечения ОА, был весьма ограничен. Основной задачей фармакологического лечения ОА являлось уменьшение боли и воспаления в суставах.
В последнюю декаду появились новые методы лечения ОА, особенно это касается создания терапевтических препаратов, действие которых направлено на определенные патогенетические механизмы заболевания, обусловливающие прогрессирование болезни на клиническом и молекулярном уровнях. Вместе с тем в отличие от ревматоидного артрита, спондилоартропатий, где наблюдается существенный прогресс в лечении, разработка эффективных лекарств при ОА наталкивается на определенные трудности. С одной стороны, ОА развивается и прогрессирует чрезвычайно медленно, что требует длительного наблюдения для доказательства влияния препарата на прогрессию болезни, с другой - до последнего времени не было четкого определения исходов болезни, так называемых "конечных" точек для оценки прогрессирования болезни и эффективности проводимого лечения.
В настоящее время для оценки течения ОА или влияния терапии на его течение разработаны и приняты международные критерии, основанные на оценке боли и функции сустава (индексы WOMAC, реже Лекена), определяющие симптом-модифицирующее действие любого метода лечения, и сужения суставной щели - для структурно-модифицирующего.
На основании этих рекомендаций исследованы несколько химических соединений, используемых для лечения ОА, и получены доказательства их влияния на симптомы и прогрессирование ОА. Наиболее изученными на данном этапе являются хондроитин сульфат (ХС) и глюкозамин (Г).
ХС присутствует преимущественно в экстрацеллюлярном матриксе большинства биологических тканей, включая хрящ, кость, кожу, связки и сухожилия. По химической структуре ХС представляет собой гликозо-аминогликан, который благодаря высокой гидрофильности участвует в транспорте воды, а также аминокислот и липидов в аваскулярных участках суставного хряща, обеспечивая нормальные физиологические процессы - вязкоэластические и механические свойства ткани. Его молекула представлена длинными полисахаридными цепями, состоящими из повторяющихся соединений дисахарида N-ацетилгалактозамина и глюкуроновой кислоты. Большинство N-ацетилгалактозаминовых остатков сульфатированы в 4 и 6-м положениях: хондроитин-4-сульфат и хондроитин-6-сульфат; каждая разновидность ХС отличается от другой молекулярным весом и, таким образом, имеет различия в чистоте и биодоступности. Полисахаридные цепи существуют в тканях только благодаря образованию ковалентных связей с белками. Формирование подобных связей приводит к образованию протеогликанов, которые вместе с коллагеновыми фибриллами обеспечивают основные свойства экстрацеллюлярного матрикса: растяжимость ткани и ее устойчивость к компрессии.
В основе дегенеративных процессов в хряще лежит потеря протеогликанов, нарушение процесса их формирования и появление механических разрывов в коллагеновой сети. Дисбаланс синтеза различных классов протеогликанов приводит к структурным изменениям в цепях ХС, проявляющимся увеличением их длины и содержанием эпитопов, распознаваемых специфическими моноклональными антителами [5].
В исследованиях in vitro показано, что ХС обладает противовоспалительной активностью и оказывает влияние на метаболизм хрящевой ткани. ХС и его фракции ингибируют хемотаксис клеток, уменьшают фагоцитоз и высвобождение лизоцима, а также защищают клеточные мембраны от воздействия кислородных радикалов. Было обнаружено, что ХС ингибирует активность лейкоцитарной эластазы и увеличивает содержание РНК в хондроцитах, что коррелирует с повышением синтеза протеогликанов и коллагена [6]. Помимо этого, ХС ингибирует интерлейкин-1-стимулированный синтез простагландинов и коллагеназы, а также активность агреканазы [7-9]. ХС уменьшает апоптоз хондроцитов [10] и ядерную транслокацию транскрипционного фактора NF-kB, индуцированную интерлейкином-1b [11].
Эффективность ХС доказана в экспериментальных и клинических исследованиях. Результаты двух последних мета-анализов, объединивших двойные слепые плацебо-контролируемые исследования по изучению эффективности и переносимости ХС у больных ОА (с преимущественным поражением коленных и тазобедренных суставов), свидетельствуют об эффективности препарата по сравнению с плацебо по влиянию на болевой синдром, функциональный индекс Лекена, уменьшению дозы принимаемых НПВП и анальгетиков [12,13].
Структурно-модифицирующее действие ХС оценивалось в длительных исследованиях. Было показано, что терапия ХС в дозе 800 мг/сут. в течение 2 лет оказывала статистически достоверное стабилизирующее влияние на ширину суставной щели у больных гонартрозом [14]. Результаты последнего исследования "STOPP" подтвердили данные предыдущей работы. На основании анализа результатов лечения ХС в течение 2 лет 622 больных гонартрозом было показано замедление прогрессирования заболевания у пациентов, леченных ХС, по сравнению с группой плацебо. В последнем мета-анализе, проведенном Hochberg M.C. с соавт. (2008), пришли к аналогичным выводам.
Г является природным аминомоносахаридом, синтезируется в организме в виде глюкозамин-6-фосфата. В суставе он входит в структуру молекул гликозамингликанов, гепаран сульфата, кератан сульфата и гиалуронана. Г является важным компонентом клеточной мембраны и поверхности клетки, играет роль в формировании хряща, связок, сухожилий, синовиальной жидкости, кожи, костей, ногтей, сердечных клапанов и кровеносных сосудов. Известны 3 соли гликозамингликана, наиболее распространены глюкозамина сульфат и глюкозамина гидрохлорид.
В эксперименте Г стимулирует продукцию гликозаминогликанов и протеогликанов, ингибирует вызванную ИЛ-1 активность агреканазы в хондроцитах. N-ацетил глюкозамин подавляет ИЛ-1 ? и ФНО-a, индуцированные продукцией оксида азота (NO) в хондроцитах хряща человека вместе с ингибицией mРНК индуцибельной формы синтазы NO и экспрессии протеина. Г восстанавливает адгезию к фибронектину [15], снижение которой ассоциируется с фибрилляцией суставного хряща [16]. Возможно, что восстановление адгезии происходит за счет активации белковой киназы С, которая вовлекается в физиологическую фосфорилизацию субъединицы a-6 А интегрина [15].
В большинстве клинических исследований использовался ХС, данных по клинической эффективности Г значительно меньше. В Европе традиционно применяется ХС, эффективность которого подтверждена в последнем исследовании GUIDE [17]. Результаты последнего мета-анализа рандомизированных контролируемых испытаний ХС также свидетельствуют об эффективности препарата по сравнению с плацебо [18]. Структурно-модифицирующее действие ХС в суточной дозе 1500 мг изучалось в 2 двойных слепых рандомизированных 3-летних исследованиях по сравнению с плацебо у больных гонартрозом [19]. Анализ результатов показал, что через 3 года у 154 больных, леченных ХС, не было выявлено статистически значимого сужения суставной щели в отличие от пациентов, получающих плацебо. Длительное наблюдение за этими больными выявило, что относительный риск эндопротезирования был достоверно ниже у больных, леченных ХС, по сравнению с группой плацебо [20].
Несколько клинических исследований сочетанного применения ХС и Г, проведенных в конце 1990-х годов in vitro и in vivo, показали их синергичное действие в отношении стимуляции синтеза матрикса и ингибиции катаболических процессов в хряще [21-23].
В настоящее время в США завершено многоцентровое двойное слепое плацебо-контролируемое клиническое исследование в параллельных группах по сравнительному изучению эффективности ХС, Г, целекоксиба, комбинации ХС и Г против плацебо у больных с гонартрозом [Glucosamine/Chondroitin Arthritis Intervention Trial (GAIT)], проводимое под эгидой Национального Института здоровья США [24]. В исследовании участвовало 1583 пациента (мужчины и женщины старше 40 лет) из 16 медицинских центров с остеоартрозом коленных суставов, 2-3-й рентгенологических стадий по Kellgren-Lawrence и болевым синдромом, длительностью минимум полгода. Результаты исследования по оценке влияния препаратов на симптомы болезни свидетельствуют о том, что комбинация ХС и Г значимо уменьшала боль по сравнению с плацебо в подгруппе больных ОА с выраженными болями в коленных суставах. Однако авторам не удалось показать структурно-модифицирующее действие всех препаратов по сравнению с плацебо, только у больных со 2-й рентгенологической стадией ОА имелось замедление сужения суставной щели, хотя и не достоверное. Эти данные, по-видимому, будут еще долго обсуждаться, как это было с оценкой симптоматического эффекта этих лекарственных средств, поскольку по не совсем понятным причинам в этом исследовании наблюдался очень высокий ответ на плацебо.
Между тем в 2008 году опубликованы результаты оценки симптоматических средств замедленного действия с использованием GRADE системы (Grading of Recommendations Assessment, Development and Evaluation), основанной на последовательной оценке качества доказательства после определения риска и пользы от применения лекарственного средства и вычисления силы рекомендаций [25], в которых доказано преимущество ХС и Г по отношению пользы и риска терапии, степень рекомендаций - сильная, качество доказательств - умеренное.
Эффективность и безопасность применения комбинированной терапии ХС и Г (препарат Терафлекс) подтверждена результатами исследования, проведенного в НИИР РАМН ревматологии, у 50 амбулаторных больных с ОА коленных суставов. Далее на основании годичного наблюдения 100 больных гонартрозом мы показали, что интермиттирующая терапия Терафлексом (лечение - 3 месяца, 3 месяца - перерыв) обладает равной эффективностью с постоянным приемом препарата по влиянию на боль, функцию суставов и по длительности последействия.
Необходимо отметить, что практически все исследования по изучению так называемых препаратов замед-ленного действия (SYSADOA - Symptomatic slow acting drugs for osteoarthritis) проводятся с обязательной сопутствующей анальгетической терапией, допускается прием либо парацетамола, либо НПВП, по сниже-нию дозы которых косвенно судят о противоболевой и противовоспалительной эффективности исследуемых средств. Это происходит потому, что, как правило, в исследование включаются больные с болью в суставе ?40 мм по визуальной аналоговой шкале, которым сразу необходима обезболивающая терапия. В то время как обсуждаемые препараты обладают отличительной особенностью, которая заключается в более позднем наступлении эффекта (через 4-8 недель от начала лечения).
Прием НПВП при усилении болей совместно с другими лекарственными препаратами, которые больной принимает для лечения сопутствующих заболеваний, приводит, как это наблюдается при длительном лечении многих хронических заболеваний, к снижению приверженности лечению и, как следствие - недостаточной эффективности проводимой терапии. Известно, что повысить комплаентность можно, либо изменяя схему лечения, например, уменьшая частоту приема лекарства, либо сочетая различные препараты в одной таблетке.
В последние годы появился новый комбинированный препарат Терафлекс-Адванс, 1 капсула которого содержит 250 мг глюкозамина сульфата, 200 мг хондроитина сульфата и 100 мг ибупрофена.
Мы провели открытое рандомизированное сравнительное исследование эффективности и безопасности препарата Терафлекс-Адванс (ТА) по сравнению с препаратами Терафлекс (Т) и ибупрофен у 60 пациентов с ОА коленных суставов.
Длительность исследования составила только 3 месяца с учетом последних рекомендаций по применению НПВП у больных ОА. Больные удовлетворяли всем критериям включения и исключения, как это было описано нами в более раних работах и в соответствии с требованиями по оценке эффективности лекарственных средств при ОА.
Пациенты были рандомизированно разделены на 3 группы, первая из которых (20 человек) принимала ТА в дозе 6 капсул в сутки, больные второй группы (20 человек) - Т 2 капсулы в сутки (1 капсула содержит 500 мг глюкозамина гидрохлорида и 400 мг хондроитина сульфата) и парацетамол в суточной дозе не более 6 таблеток в сутки (3 г). Группа 3 (20 человек) - ибупрофен в дозе 600-1200 мг/сут. (по потребности).
Оценка эффективности лечения проводилась по критериям оценки препаратов для лечения ОА: индекс WOMAC, оценка эффективности лечения врачом и пациентом, скорость ходьбы (15 м).
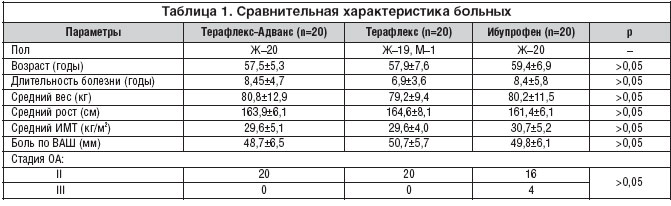
Все больные, включенные в исследование, были сопоставимы по возрасту, давности болезни, индексу массы тела (ИМТ) кг/м2 и боли по ВАШ (табл. 1). Из 60 пациентов, включенных в исследование, полный курс лечения завершили 58 больных (96,6%). Две пациентки выбыли из группы, получавшей ибупрофен: 1 - в связи с развитием эрозивного гастрита, другая - из-за аллергической реакции (крапивница).
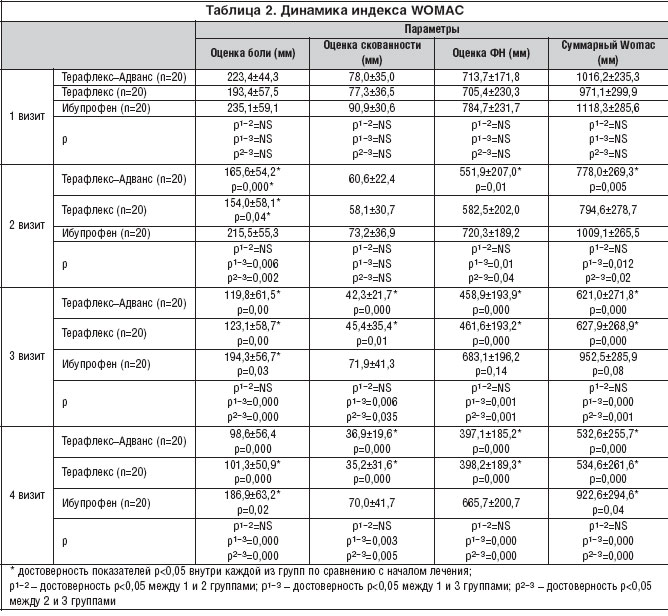
Уже через 1 месяц лечения наблюдалось достоверное снижение боли у пациентов, получающих ТА и Т, эффект сохранялся до конца исследования. В группе ибупрофена боль уменьшалась медленнее и достоверное различие было достигнуто только через 2 месяца терапии.
Значимое снижение скованности отмечалось через 2 месяца терапии в группах ТА и Т.
Мы отметили более быстрое улучшение показателей функционального состояния суставов и снижение суммарного индекса WOMAC у больных на ТА в конце 1-го месяца лечения; а в группе Т достоверные результаты по этим показателям были получены через 2 месяца терапии; у больных 3 группы суммарный индекс WOMAC достоверно снизился по сравнению с началом лечения только в конце наблюдения. Скорость ходьбы возросла через 3 месяца лечения в двух первых группах (табл. 2).
Оценки эффективности лечения, проводимые пациентом и врачом, практически не отличались. В конце исследования практически все больные, леченные ТА и Т отметили улучшение, а в 3 группе - только половина больных.
Переносимость терапии в целом была хорошая. Нежелательные явления (НЯ) были зарегистрированы у 11 больных. В группе, получавшей Терафлекс-Адванс, у 3 больных, у двух из которых на 3-4-й день лечения возникли боли в эпигастрии, которые купировались омепразолом. У третьей пациентки через неделю лечения появились небольшие отеки нижних конечностей. Эти НЯ были малой интенсивности и не потребовали отмены или прекращения лечения. По всей вероятности, их развитие обусловлено наличием в составе препарата ибупрофена, поскольку у больных, получавших Терафлекс и ибупрофен, нежелательных явлений не было.
На фоне ибупрофена выбыли из исследования 2 больных: у 1 - в первые дни терапии появилась крапивница, прошедшая после приема супрастина на 2-й день, у второй больной препарат был отменен на 6-й день терапии в связи с развитием эрозивного гастрита (подтверждено ЭГДС). Еще 6 больных на 2-4-й день лечения предъявляли жалобы на боли в эпигастральной области. НЯ были не выраженными, прошли после добавления к терапии омепразола, больные продолжили участие в исследовании.
Таким образом, на основании полученных результатов можно заключить, что препарат Терафлекс-Адванс, обладая хорошей переносимостью, быстрее по сравнению с терафлексом и ибупрофеном уменьшает боль, скованность и улучшает функцию суставов. Терафлекс-Адванс может быть рекомендован при ОА в первые месяцы лечения хондропротекторами с последующей заменой его на Терафлекс, а также при обострении заболевания.
Литература
1. Reginster JY. The prevalence and burden of arthritis. Rheumatology 2002;41:3-6.
2. Lawrence RC, Helmick CG, Arnett FC, et al. Estimates of the prevalence of arthritis and selected musculoskeletal disorders in the United States. Arthritis & Rheum. 1998;41:778-799.
3. Martel-Pelletier J, Lajeunesse D, Pelletier JP :Etiopathogenesis of osteoarthritis. In Arthritis and Allied Conditions: A Textbook of Rheumatology. Edited by: Koopman WJ, Moreland LW. Baltimore: Lippincott, Williams Wilkins; 2005:2199-2226.
4. Lajeunesse D, Massicotte F, Pelletier JP, Martel-Pelletier J :Subchondral bone sclerosis in osteoarthritis: not just an innocent bystander. Modern Rheumatology 2003, 13:7-14.
5. Hardingham TE. Chondroitin sulfate and joint disease. Osteoarthritis & Cartilage 1998; 6:3-5.
6. Baici A., Bradamante P. Interaction between human leukocyte elastase and chondroitin sulfate. Chem. Biol. Interaction, 1984, 51:1-11.
7. Lippielo L., Grande D. In vitro chondroprotection of glucosamine and chondroitin sulfate in a rabbit model of a OA and demonstration of metabolic synergy on chondrocyte in vitro. Ann. Rheum. Dis., 2000, 59 (Suppl 1):266.
8. Yaron I., Shirasi R., Judovich R., Yaron M. Chondroitin sulfate inhibits prostaglandin E2 production in synovial cell cultures and reverses IL-1 inhibition of cartilage synthesis. Ann. Rheum. Dis., 2000, 59 (Suppl 1):265.
9. Ronca F,Palmieri Let al. Anti-inflammatory activity of chondroitin sulfate. Osteoarthritis Cartilage 1998; 6 (suppl A): 14-21.
10. Reveliere D, Mentz F, Merie-Beral H et al. Protective effect of chondroitin 4,6-sulfate on apoptpsis of rabbit articular chondrocytes^ preliminary resultes. In: Mautone G, Tajana E, Rovati S, Vacher D, editors. New appoaches in OA. Zurich:Litera Rheumatologica 24, EULAR;1999:15-20.
11. Jomphe C, Gabriac M, Hale TM et al., Chondroitin sulfate inhibits the translocation of nuclear factor-kB in interleukin-1b-stimulated chondrocytes. Basic Clin Pharmac Toxicol; 2008, 102:59-65.
12. Bana G., Jamard B., Verrouil E., Mazieres B. Chondroitin sulfate in the management of hip and knee OA: an overview. Adv. Pharmacol., 2006, 53:507-522.
13. Uebelhart D., Knols R., de Bruin E.D., Verbruggen G. Chondroitin sulfate as a structure-modifying agent. Adv. Pharmacol., 2006, 53:475-488.
14. Michel B.A., Stucki G., Frey D., et al. Chondroitin 4 and 6 sulfate in osteoarthritis of the knee: A randomized, controlled trial. Arthritis Rheum., 2005, 52 (3): 779-786.
15. Pipermo M, Reboul P, Hellio Le Graverand MP, et al. Glucosamine sulfate modulates dysregulated activities of human osteoarthritis chondrocytes in vitro. Osteoarthritis & Cartilage 2000; 8:2007-212.
16. Abelda SM, Buck CA. Integrins and other cell adhesion molecules. FASEB J 1990;4:2868-2880.
17. Herrero-Beaumont G, Ivorra JA, Del Carmen Trabado M, et al. Glucosamine sulfate in the treatment of knee osteoarthritis symptoms: a randomized, double-blind, placebo-controlled study using acetaminophen as a side comparator. Arthritis Rheum. 2007;56:555-67.
18. Towheed TE, Maxwell L, Anastassiades TP, et al. Glucosamine therapy for treating osteoarthritis. Cochrane Database Syst Rev. 2005(2):CD002946.
19. Register J-Y, Rovati L, Deroisy R et al. Glucosamine sulfate slows-down osteoarthritis progression in postmenopausal women : pooled analysis of two large, independent, randomized, placebo-controlled, double-blind, prospective 3-year trials. Ann Rheum Dis 2002, 61 (Suppl 1):THU0196.
20. Poolsup N, Suthisisang C, Channark P, Kittikulsuth W. Glucosamine long-term treatment and the progression of knee osteoarthritis: systematic review of randomized controlled trials. Ann Pharmacother. 2005;39:1080-87.
21. Lippielo L., Woodword J., Karpman D. et al.Beneficial effect of cartilage structure modyifing agents tested in chondrocyte and rabbit instability model osteoartrosis. Arthr. Rheum., 1999, suppl. 42, 256
22. Leffler CN, Phillipi AF, Leffter SG et al. Glucosamine, chondroitin and magnaese ascorbate for degenerative joint disease of the knee or low back pain: a randomized, double-blind, placebo-controlled pilot study. Mil.Med 1999, 164:85-91.
23.. Shanklad WE, The effects of glucosamine and chondroitin sulfate on osteoarthritis of the TMJ: a preliminary report of 50 patients. Cranio 1998, 16:230-235.
24. Clegg DO, Reda DJ, Harris CL, et al. Glucosamine, chondroitin sulfate, and the two in combination for painful knee osteoarthritis.// N Engl J Med. 2006 Feb 23;354(8):795-808.
25. Bruyere O, Burlet N, Delmas P, et al. Evaluation of Symptomatic Slow-Acting Drugs in Osteoarthritis Using the GRADE System. BMC Musculoskelet Disord , 2008. © 2008 BioMed Central, Ltd.
Источник РМЖ 2009 г, том 17, № 3













