Клиренс креатинина менее 65 мл/мин как достоверный и независимый от мышечной силы фактор риска падений и переломов у пожилых мужчин и женщин с остеопорозом
Ducas L., Schacht E., Runge M.
Введение
Предрасположенность пожилых людей к падениям, которые часто заканчиваются ограничением двигательной активности и функциональными нарушениями, возникает в результате возрастных изменений и сопутствующих хронических заболеваний (саркопения, нарушения баланса, нейромышечные расстройства, артрит и т.д.) [1].
D-гормон (кальцитриол) играет ключевую роль в процессах формирования, ремоделирования и поддержания костной массы, а также является необходимым для сохранения силы, функций и баланса у пожилых [2-4]. В трех рандомизированных контролируемых исследованиях [5-7] было показано существенное снижение частоты падений у женщин с дефицитом витамина D на фоне приема кальцидола [5]. Также достоверное снижение количества падений было зафиксировано на фоне приема кальцитриола [6] либо альфакальцидола [7] пожилыми людьми, проживающими в домах престарелых и имеющими нормальный уровень (по определению ВОЗ) 25-гидроксивитамина D [25(OH)D>30 нг/мл]. По данным четырехлетнего обсервационного исследования, Фолкнер с соавт. описали важную взаимосвязь между нормальным уровнем кальцитриола в сыворотке и снижением риска падений [8]. Данные результаты могут быть объяснены дополнительным влиянием D-гормона на мышечную силу и функцию, а также на способность к удержанию баланса. Воздействуя непосредственно на высокоселективные D-гормон-рецепторы (VDR), D-гормон влияет на мышечную ткань [9], стимулируя синтез мышечных протеинов и увеличивая размер и дифференциацию мышечных волокон [10,11].
Недавно опубликованные исследования продемонстрировали достоверную связь между клиренсом креатинина, снижением уровня кальцитриола в сыворотке и повышенным риском падений и остеопорозных переломов [7,8,12-16].
Целью настоящего исследования явилась проверка предположения, что низкий клиренс креатинина
(< 65 мл/мин) является показателем снижения уровня кальцитриола в сыворотке крови и непосредственно связан со снижением мышечной силы и способности к удержанию баланса, количеством падений, упавших и связанных с падениями переломов у пожилых пациентов с диагностированным остеопорозом.
Пациенты и методы
Настоящее перекрестное исследование проводилось с мая по октябрь 2005 г. в Германии для того, чтобы оценить взаимосвязь между клиренсом креатинина и результатами тестов на мышечную силу и баланс, числом падений и упавших и связанных с падениями переломами у пожилых (65 лет и старше) мужчин и женщин с диагностированным остеопорозом.
В исследовании приняли участие 287 германских медицинских центров. К исследованию были привлечены врачи различных специальностей (врачи общей практики, терапевты, ортопеды), занимающиеся лечением остеопороза. Врачи заполняли опросник в отношении пациентов, получающих антиостеопоротическую терапию, а также проводили тесты, позволяющие оценить мышечную силу и способность к удержанию баланса. Опросники для исследования заполнялись в ходе визитов и при помощи пациентов, получавших антиостеопоротическую терапию. Три теста на оценку мышечной силы были взяты из официальных немецких рекомендаций по оценке рисков падений у пациентов.
Опросники содержали следующие данные:
o демографические параметры (пол, возраст, вес, рост);
o дата, когда был диагностирован остеопороз (день/месяц/год);
o методы диагностики - двухэнергетическая рентгеновская абсорбциометрия (DEXA), ультразвуковая денситометрия, рентген;
o длительность антиостеопоротической терапии (варианты: "от и до" либо долгосрочная терапия);
o тип антиостеопоротической терапии (варианты: бисфосфонаты, фториды, кальцитонины, ралоксифен, другое, отсутствие терапии);
o наличие деформаций позвоночника (да/нет);
o количество падений за последние 12 мес. (несинкопальные/синкопальные);
o количество остеопоротических переломов за последние 12 мес., их обстоятельства (связаны с падениями, не связаны с падениями, число тех и других) и локализации (связанных с падениями, не связанных с падениями);
o уровень креатинина сыворотки крови;
o клиренс креатинина (расчетная величина).
Опросник не давал информации о том, при помощи каких методов были диагностированы переломы. Клиренс креатинина рассчитывался посредством общепринятой формулы Кокрофта - Голта с коррекцией по гендерному признаку [17]. В отличие от прямого измерения скорости клубочковой фильтрации (СКФ) в суточной моче или определения клиренса инулина формула Кокрофта - Голта дает только возможность оценить СКФ, тем не менее она широко распространена и применяется в качестве простого и удобного инструмента для расчета клиренса креатинина (CrCl). Пациенты, получавшие альфа-кальцидол или кальцитриол, были исключены из исследования.
Падения были определены как "непреднамеренный переход в состояние покоя на земле, полу или другом низком уровне". Врачи, принимавшие участие в исследовании, прошли тренинг по заполнению протокола падений (дата, время, обстоятельства и повреждения).
Диагностические критерии остеопороза, используемые врачами, в ходе исследования не оценивались, то есть диагноз остеопороза фиксировался исключительно на основании отчета врача. Падения подразделялись на истинно несинкопальные либо синкопальные, однако более узкая классификация истинно несинкопальных падений не проводилась. Эпизод падения в течение последних 12 мес. фиксировался в истории болезни каждого пациента (а не основывался на воспоминаниях).
Оценка функций
Установление взаимосвязи между CrCl, двигательными функциями и способностью к удержанию баланса, которые оценивались при помощи теста на скорость подъема и ходьбы (TUG), теста на подъем со стула (CRT) и тандем-теста (TST), являлось основным результатом данного перекрестного исследования. Врачи и медицинские сестры, принимавшие участие в исследовании, прошли тренинг по проведению упомянутых тестов.
По данным Подсиалдо и Ричардсона, TUG является инструментом для оценки двигательных функций, состояния мышц, скорости ходьбы и способности к удержанию баланса [18]. Он позволяет эффективно произвести оценку функциональной подвижности, необходимой пациенту в повседневной жизни [18]. Данный тест позволяет реально оценить двигательные возможности пациента, включая потенциальный риск падений (оценка подъема и усаживания на стул, движения вперед, разворота) [19]. В процессе наблюдения за пациентом оцениваются время подъема со стула (высота сиденья 48 см, высота ручек 68 см), прохождения дистанции в 3 м с нормальной скоростью, обхода препятствия на полу (например, кирпич на расстоянии 3 м от стула), разворота и возвращения на стул. Пациентам разрешается пользоваться ручками стула при подъеме. Должно проводиться только одно испытание. Чем больше времени уходит у пациента на выполнение TUG, тем ниже считается его результат. Не так давно в ходе 10-летнего исследования было показано, что TUG может не только использоваться для оценки функциональной подвижности пациента, но также служить в качестве предиктора внепозвоночных переломов: увеличение времени прохождения теста на 1 стандартное отклонение (2,6 с) приводило к возрастанию риска невертебральных переломов на 24% [20].
По данным Гуралинк с соавт. и Джилл с соавт. [21,22], TST является тестом на баланс. Вначале пациента просят 10 с удержаться в позиции с плотно сведенными вместе стопами, затем на 10 с принять позицию полутандем ("гуськом", ноги на небольшом расстоянии), а затем - полный тандем ("гуськом", когда обе ноги находятся строго на одной линии и каблук стоящей впереди ноги упирается в носок другой). Разрешается максимум 3 попытки, из которых наилучшая принимается за окончательный результат. Неспособность находиться в этой позиции как минимум 10 с указывает на высокий риск падений. Чем дольше пациент может находиться в TST позиции, тем лучше его результат.
В тесте на подъем со стула (CRT) для проверки мышечной силы испытуемый должен был пять раз встать и сесть на стул обычной высоты без помощи рук (руки скрещены на уровне груди) с максимально возможной скоростью [19,21,23]. Испытуемому предоставляется только одна попытка. Пациенты, которые не могли подняться и сесть пять раз или выполняли тест более чем за 10 с, автоматически попадали в группу с высоким риском падений. Чем больше времени требуется пациенту для выполнения CRT, тем хуже считается его результат.
Статистический анализ
Для основного анализа мы использовали ранговую корреляцию Спирмена, логистический регрессионный анализ и объединенные модели линейной регрессии для одновременного контроля нескольких потенциально смешанных переменных. Сравнения значений проводились посредством многофакторного скорректированного дисперсионного анализа [24]. Так как распределения параметров возраста и индекса массы тела (ИМТ) были явно асимметричны, до проведения анализа было выполнено логарифмическое преобразование этих переменных. Т.к. распределение TUG также не имело нормальной формы, мы использовали его логарифмическое преображение. Мы включили в исследование коварианты, связанные с функциональными характеристиками, которые использовались в предложенных нами моделях либо в более ранних исследованиях [25,26]. Данными ковариатами явились: пол (мужской, женский), который анализировался как дихотомическая переменная; возраст; ИМТ и CrCl, который анализировался как непрерывная переменная. Для всех анализов мы использовали t-тест (метод Стьюдента), критерий суммы рангов Уилкоксона, критерий хи-квадрат (Пирсона).
Для всех анализов мы использовали SAS версию 9.1 SAS Institute Inc., Cary, NC, USA, по лицензии Универ-ситета Базеля, Швейцария.
Результаты исследования оценивал Независимый комитет по мониторингу данных, основанный в рамках GWD Consult Germany (Data, Safety and Monitoring Board: GWD Consult, Research Contract, Postfach 1210, 63152 Mulheim/Main, Germany).
Результаты
Демографические данные
В исследовании приняли участие 1410 женщин (79,2%) и 371 мужчина (20,8%). Средний возраст участников составил 74,2 года. В среднем участники имели небольшое превышение нормальной массы тела - ИМТ 26,1 кг/м2 (табл. 1).
Женщины в исследовании были несколько старше мужчин, средний возраст женщин - 74,6 года (диапазон возраста 61-99 лет), средний возраст мужчин составил 72,9 года (диапазон возраста 61-90 лет)]. По результатам тестов на функцию мышц и способность к удержанию баланса, женщины оказались значительно медленнее мужчин в тесте на подъем со стула (CRT) - среднее время выполнения 13,5 с против 12,1 с у мужчин, p=0,05, в то время как для тестов TUG и TST не было показано статистически значимого различия по гендерному признаку.
Клиренс креатинина, остеопороз, терапия остеопороза и падения
Среднее значение CrCl у участников исследования составило 60,2 мл/мин, у 1130 участников (63,5%) CrCl был <65 мл/мин. Женщины были гораздо более склонны к низкому клиренсу креатинина, чем мужчины (68,65% против 43,67%, p<0,0001).
Диагноз "остеопороз" был поставлен 19,9% от всех 1410 участников в течение года исследования, большинство из участников (63,75%) знали о своем диагнозе не более 5 лет. Остеопороз, диагностированный более 5 лет назад, имелся только у 16,35% участников исследования. В 42,7% диагноз остеопороза был поставлен только по результатам DEXA, в 17,4% - по данным DEXA и рентгенографии (тотальная DEXA 60,1%), в 4,4% - при помощи УЗИ пяточной кости и в 34,5% - только при помощи рентгенографии. На момент исследования 36,4% из 1410 пациентов получали терапию бисфосфонатами, 4,6% - фтористыми соединениями, 3,8% - кальцитонином, 2,2% - ралоксифеном, и 3,8% - неспецифическую для остеопороза терапию. Из 1410 участников 54,2% не получали специальную терапию против остеопороза, и 9,4% из 1410 участников не имели информации о терапии. Из 1410 пациентов, 61,2% получали терапию витамином D и кальцием.
У 70,4% участников имелись вертебральные деформации, более ярко выраженные у участников с клиренсом креатинина <65 мл/мин по сравнению с участниками с клиренсом креатинина ?65 мл/мин (73,4% против 64,3%, p<0,001).
В течение 12 мес. до начала исследования было зарегистрировано 907 падений. Среди участников, которые сообщили о падении, 43,1% сообщили об однократном падении, 56,9% - о множественных падениях. Пациенты с клиренсом креатинина менее 65 мл/мин чаще сообщали о несинкопальных (необморочных) падениях и были более склонны к множественным падениям по сравнению с пациентами с клиренсом креатинина ?65 мл/мин (47,7% против 36,2%, p=0,0008, множественный контроль и 28,0% vs. 18,4%, p<0,001, множественный контроль, соответственно). Что касается синкопальных (обморочных) падений, мы не обнаружили существенного различия между группами в зависимости от CrCl (<65 мл/мин против >65 мл/мин; 9,7% против 13,8%, p=0,13). Терапия остеопороза не оказывала влияния на падения.
Результаты тестов на мышечную силу и баланс, клиренс креатинина и их связь с эпизодами падений
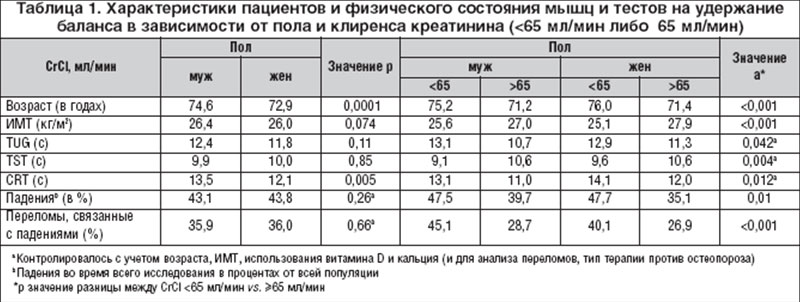
CrCl <65 мл/мин, контролируемый с учетом возраста, пола и ИМТ, в сравнении с CrCl ?65 мл/мин был связан с существенно более высокой частотой падений (ОР 1,40; 95% ДИ 1,12-1,74, p=0,002) и значительно большим риском множественных падений (ОР 1,42; 95% ДИ 1,09-1,85, p=0,010). Снижение CrCl в значительной степени ассоциировалось с худшими результатами тестов на баланс: TUG (корр. -0,2337, p<0,0001), CRT (корр. -0,1706, p<0,0001) и TST (корр 0,2193, p<0,0001). Данные изменения были достоверно выражены у обоих полов, однако коэффициент корреляции по всем тестам был выше у мужчин (табл. 1, рис. 1).
В соответствии с полученными результатами участники с CrCl<65 мл/мин продемонстрировали значительно худшие результаты тестов TUG (13,0 с против 11,1 с, p=0,005), TST (9,5 с против 10,6 с, p<0.001), CRT (14,0 с против 11,7 с, p=0.003) по сравнению с участниками с CrCl ?65 мл/мин (при сходных показателях возраста, пола и ИМТ).
Результаты тестов TUG и TST в значительной степени были связаны с числом падений (точечная оценка, -0,05, p<0,0007; соотв., 0,06, p<0,0001) и количеством часто падавших пациентов (точечная оценка, -0,05, p<0,0002; соотв., 0,07, p<0,0001), в то время как CRT не был связан с частотой падений (p=0,43) а только с количеством часто падавших пациентов (точечная оценка, 0,028, p=0,02). Множественно контролируемый (включая результаты тестов TUG, TST и CRT) низкий CrCl<65 мл/мин тем не менее остается мощным предиктором падений (ОР 1,35, 95%ДИ 1,06-1,73, p=0,016) и числа часто падающих пациентов (ОР 1,40, 95% ДИ1,04-1,87, p=0,023).
Переломы, связанные с падениями, и клиренс креатинина
Из всех участников исследования у 36% имелся перелом, связанный с падением, в течение последних 12 мес. (n=641) включая 6,7% пациентов с более чем одним переломом, связанным с падением. Пациенты с CrCl<65 мл/мин значительно чаще (на 44%) имели в анамнезе перелом, связанный с падением, чем пациенты с CrCl ?65 мл/мин (33,1% против 22,9%, p=0003, множественный контроль). В 95% была определена локализация перелома: 39,5% составили вертебральные переломы, 20,4% - переломы бедра, 26,3% - переломы лучевой кости и 13,8% - другая локализация (главным образом ступни и плечо/плечевая кость). Пациенты с CrCl<65 мл/мин продемонстрировали существенно большее число вертебральных переломов (ОР, 1,50, 95% ДИ 1,04-2,15, p=0,03), переломов бедра (ОР, 1,82, 95% ДИ 1,14-2,91, p=0,012) и переломов лучевой кости (ОР, 1,73, 95% ДИ 1,15-2,60, p=0,012) и не столь значительное число переломов другой локализации (ОР, 1,54, 95% ДИ 0,68-3,51, p=0,205), чем участники с CrCl ?65 мл/мин (с учетом возраста, пола, ИМТ и терапии остеопороза).
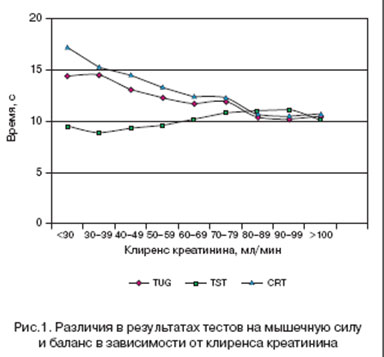
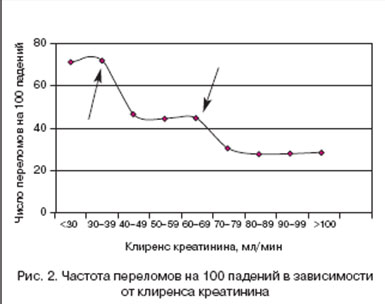
Частота переломов, связанных с падениями, была в значительной степени связана с уровнем CrCl (p<0,0001). Мы наблюдали ступенчатое возрастание числа переломов, связанных с падениями: у пациентов с CrCl ?70 мл/мин риск переломов, связанных с падением, составил в среднем 28,9%. При CrCl от 40 до 70 мл/мин средний риск переломов, связанных с падением, составил 45,3%, что существенно (в 1,56 раза) превысило таковой риск при CrCl ?70 мл/мин (p<0,001). CrCl менее 40 мл/мин в среднем повышал риск переломов, связанных с падением до 71,6%, то есть в 2,47 раза выше риска у пациентов с CrCl ?70 мл/мин (p<0,0001) (рис. 2).
Всего было зарегистрировано 137 не связанных с падениями переломов, главным образом вертебральных (n=113, 82,5%). Мы не обнаружили статистически значимого различия для не связанных с падениями переломов в зависимости от клиренса креатинина (<65 мл/мин против ?65 мл/мин, 7,9% против 6,9%, p=0,46).
Обсуждение
В данном исследовании мы показали, что пожилые мужчины и женщины, страдающие остеопорозом, с CrCl<65 мл/мин продемонстрировали существенно худшие результаты в тестах на мышечную силу и баланс, имели большее число падений и переломов в анамнезе и были в большей степени склонны к час-тым падениям по сравнению с пожилыми мужчинами и женщинами, страдающими остеопорозом, с CrCl ?65 мл/мин. CrCl<65 мл/мин, выступая в качестве суррогатного маркера пониженного уровня кальцитриола в сыворотке, вне зависимости от результатов тестов на мышечную силу и баланс, был достоверно ассоциирован с более высокой частой падений и переломов.
Сохранение функциональной способности и подвижности пожилых пациентов повышает их самостоятельность и может существенно снизить нагрузку на бюджет здравоохранения [27-29]. Пути улучшения и поддержания функциональной способности в процессе старения актуальны для современных исследований и здравоохранения. Появляется все большее количество доказательств того, что альфа-кальцидол и кальцитриол, помимо их хорошо известного влияния на костный метаболизм [30,31], усиливают мышечную силу [32,33] и снижают количество падений и связанных с ними переломов у пожилых пациентов [6,7,14,15]. Мышечная слабость оказывает негативное влияние на способность поддержания баланса и функциональную подвижность, что приводит пожилого пациента к повышенному риску падений и переломов [34]. Взаимосвязь между кальцидиолом, D-гормоном и мышечной силой была изучена в доклинических исследованиях, обсервационных исследованиях и рандомизированных контролируемых исследованиях. Большая часть исследователей сошлись во мнении, что активные метаболиты витамина D важны (если не жизненно необходимы) для поддержания нормальной мышечной силы [11]. В предыдущих публикациях было показано, что амбулаторные пожилые пациенты с повышенной концентрацией D-гормона в сыворотке демонстрировали лучшую силу экстензии ног [2] и улучшенную мышечную функцию [4] по сравнению с пожилыми пациентами с низкой концентрацией D-гормона в сыворотке. Stein и коллеги наблюдали низкую концентрацию кальцидиола и высокую концентрацию паратгормона (ПТГ) в сыворотке пожилых часто падающих пациентов [35]. Faulkner и коллеги показали, что только высокие концентрации D-гормона достоверно связаны со сниженным риском падений у пожилых женщин, живущих в домах престарелых, тогда как добавки нативного витамина D и концентрации кальцидиола и ПТГ не связаны ни с нейромышечной функцией, ни с падениями [8].
Старение связано со снижением почечной функции [36, 37], что легко определить по снижению уровня CrCl. Это приводит к снижению активности почечной 1 ?-гидроксилазы [38-40] и, следовательно, к снижению уровня D-гормона в сыворотке [41-43]. Мышечная сила, способность к поддержанию баланса и функциональная подвижность зависят от уровня D-гормона в сыворотке [2,4,6,10,37,44-47]. В недавно опубликованном исследовании, включавшем почти 700 женщин в возрасте от 65 лет и старше, методом случай-контроль Ensrud и коллеги показали, что риск нового перелома бедра возрастает в 2,3 раза у женщин со средней степенью недостаточности почечной функции (CrCl<45 мл/мин) и в 1,6 раза у женщин с уровнем CrCl от 45 до 59 мл/мин в сравнении с женщинами имеющими CrCl>60 мл/мин [16].
Риск чрезвертельного перелома бедра был даже выше и увеличивался в 7,2 раза у женщин с CrCl<45 мл/мин и в 3,9 раза у женщин, имеющих CrCl от 45 до 59 мл/мин, по сравнению с уровнем CrCl>60 мл/мин [16]. Однако риск вертебральных переломов не был настолько прямо связан с почечной функцией [16]. Данные результаты согласуются с результатами перекрестного проспективного когортного исследования, включившего 1713 здоровых мужчин и женщин со средним возрастом 71 год, живущих в домах престарелых [37]. В исследовании Rancho Bernardo была показана характерная линейная зависимость между почечной функцией и минеральной плотностью бедренной кости. Кроме того, соответствующая взаимосвязь была показана между почечной функцией и тандем-тестами стоя и в движении - TST и TGT [37].
В ряде исследований было показано [6,7], что терапия D-гормоном (альфа-кальцидолом или кальитриолом) существенно снижает риск падений и связанных с ними переломов. В одном из исследований было показано, что назначение альфакальцидола живущим в домах престарелых пожилым мужчинам и женщинам с CrCl<65 мл/мин в значительной степени снижает связанный с низким CrCl риск падений [13]. В другом плацебо-контролируемом исследовании с участием 489 женщин в возрасте от 65 до 77 лет Gallagher и коллеги недавно подтвердили, что CrCl<60 мл/мин является статистически значимым предиктором падений [15]. Также в этом исследовании была показана оценка риска падений и связанных с падениями переломов, аналогичная той, которую мы представили в данном исследовании.
Аналогичный риск падений и связанных с падениями травм был описан в исследовании Gryfe и коллег [48]. В группе с низким CrCl (<60 мл/мин) в исследовании Gallagher и коллег [15] коэффициент падений уменьшался в результате 3-летней терапии D-гормоном на 53% (p=0,003) и на 30% в группе с CrCl >60 мл/мин. В группе плацебо женщины с CrCl<60 мл/мин имели исходно на 60% более высокий коэффициент по истории падений по сравнению с группой с CrCl ?60 мл/мин (p=0,007). В сравнении с женщинами, имеющими CrCl l60 мл/мин, женщины с CrCl<60 мл/мин демонстрировали более низкую абсорбцию кальция (p<0,001), пониженный уровень D-гормона в сыворотке (p<0,001), сниженные физические показатели и при этом нормальный уровень кальцидиола сыворотки (p<0,05), что предполагает пониженную конверсию 25(OH)D в 1,25(OH)2D (D-гормон) при снижении CrCl ниже 60 мл/мин. Кроме того, снижение почечной массы у пожилых, повышение уровня С-реактивного белка, повышение уровня цитокинов сыворотки и/или увеличение концентрации фактора роста фибробластов 23, который продуцируется для поддержания нормального уровня фосфатов крови, ингибируют почечную 1 гидроксилазную активность, и, таким образом, некоторые из вышеперечисленных факторов могут оказывать прямое отрицательное воздействие на качество кости и мышечную силу [40,49,50]. Подводя итог, можно сказать, что низкий уровень CrCl связан с повышением риска развития остеопении и остеопороза [14,15,27,37,51], снижением физических показателей, повышением частоты падений и переломов бедра и, возможно, увеличением немощности.
Полученные нами результаты и результаты других исследований [2,4,6,11,15,16,20,34-36,38,50,52] позволяют сделать предположение, что кальцитриол непосредственно вовлечен в патогенетический процесс, приводящий к снижению мышечной силы и ухудшению балансировки, и, таким образом, связан с падениями и переломами. Снижение уровня кальцитриола в сыворотке и/или низкая концентрация в органе-мишени являются факторами риска падений и связанных с ними переломов. Однако в данном исследовании мы косвенно показали (используя клиренс креатинина <65 мл/мин в качестве суррогатного маркера снижения уровня кальцитриола в сыворотке), что вне зависимости от мышечной силы и способности к поддержанию баланса снижение уровня кальцитриола в сыворотке является фактором риска падений и связанных с ними переломов. Таким образом, кальцитриол, помимо его влияния на мышцы и кости, может оказывать дополнительные эффекты, например, на нервно-мышечную передачу или когнитивные функции. На эту тему существует немного исследований. В мозге имеются рецепторы кальцитриола [53], и было показано, что уровень кальцидиола в сыворотке, также как и уровень кальцитриола [54], в значительной степени коррелируют с когнитивной функцией, результатами различных когнитивных тестов и депрессией у пожилых пациентов [55]. В исследованиях на мышах с модифицированным геном было показано, что нарушение рецептора к витамину D (VDR) ведет к мышечным и моторным повреждениям, которые существенно влияют на локомоторное поведение [11, 56].
Предполагается, что повышение уровня D-гормона в сыворотке крови и/или органах-мишенях активирует VDR в мышцах, при этом мы не можем исключить активацию VDR в мозге и влияние на центральную нервную систему [15, 57].
Интересно отметить, что вместо линейного повышения риска переломов, связанных с падениями, мы наблюдали в данном исследовании ступенчатый рост, а именно повышение риска на 56% при CrCl в интервале от 40 до 70 мл/мин и на 147% при CrCl<40 мл/мин по сравнению с уровнем CrCl ?70 мл/мин. Как было описано ранее, мы и другие исследователи наблюдали значительное снижение уровней D-гормона в сыворотке при CrCl<65 мл/мин. Зависящий от CrCl рост уровня интактного ПТГ в сыворотке был описан рядом авторов [38,58,59] при снижении CrCl ниже 40 мл/мин. Следовательно, мы предложили следующую гипотезу - возрастание риска переломов, связанных с падениями, носит двухступенчатый характер: сначала достигается критическая точка снижения уровня D-гормона в сыворотке (ассоциированная с уровнем CrCl), а затем возрастает риск переломов, связанных с падениями, при достижении критической точки повышения уровня ПТГ в сыворотке (которая также ассоциирована с уровнем CrCl). Для подтверждения этой гипотезы необходимы дальнейшие исследования. В случае подтверждения откроются новые возможности более дифференцированного подхода к терапии переломов, связанных с падениями.
Наше исследование имело ряд ограничений; хорошо известны таковые в трактовке результатов перекрестного исследования. Исход вариабельной величины "падения" оценивался посредством воспоминания пациента с присущей ему систематической ошибкой оценки. В отношении переломов, связанных с падениями, мы также не оценивали то, каким образом переломы диагностировались и подтверждались, не оценивали историю переломов, что могло быть важным контрольным параметром для данного исхода. В целом мы также не могли контролировать другие важные независимые переменные, такие как сопутствующие заболевания, число принимаемых препаратов, физическую активность и т.д. Таким образом, мы не можем исключить неконтролируемые усложняющие факторы. Более того, диагноз "остеопороз" основывался только на различных радиологических методах, и потому мы не исключаем ошибки классификации при постановке диагноза "остеопороз". Можно принять, что подобная возможная ошибка относится ко всей исследуемой группе и не отражается на результате исследования по влиянию низкого уровня CrCl на мышечную силу и баланс, а также на частоту падений и переломов в данной популяции. Участниками исследования стали пожилые белые мужчины и женщины в возрасте старше 65 лет, получавшие терапию против остеопороза. Не у всех пациентов диагноз "остеопороз" базировался на результатах денситометрии. Таким образом, наши результаты не могут быть обобщены для всей популяции пациентов, страдающих остеопорозом (например, для более молодой популяции или пациентов другой расовой принадлежности).
Подводя итоги, можно сделать заключение, что мышечная сила и способность к поддержанию баланса по оценке тестов TUG, TST и CRT в значительной степени связаны с уровнем CrCl. CrCl<65 мл/мин был ассоциирован со значительно худшими результатами тестов на мышечную силу и способность к поддержанию баланса. Неожиданным для нас явилось, что CrCl<65 мл/мин, вне зависимости от результатов тестов на мышечную силу и балансировку, был достоверно ассоциирован с более высокой частотой падений и переломов. Поскольку CrCl<65 мл/мин может рассматриваться в качестве суррогатного маркера низкого уровня кальцитриола в сыворотке, мы пришли к выводу, что стратегии профилактики и реабилитации должны ставить целью коррекцию дефицита D-гормона у пожилых мужчин и женщин с CrCl<65 мл/мин для поддержания мышечной силы и баланса и предотвращения падений и связанных с ними переломов.
Низкий уровень CrCl может послужить прогностическим инструментом снижения МПК бедра, уменьшения прочности кости, ослабления мышечной функции, повышенного риска падений и связанных с ними переломов и, возможно, немощности. Очень полезная диагностика синдрома немощности, определяемого как уменьшение прочности костной ткани, снижение подвижности, нарушение когнитивных функций и повышенный риск падений и переломов, особенно переломов бедра, может быть произведена простым расчетом CrCl по уровню креатинина сыворотки крови на основе формулы Кокофта-Голта (Cockcroft-Gault). Эта привлекательная гипотеза требует своего подтверждения в рамках дальнейших клинических исследований, так как возможность замедлить немощность до того, как она перейдет в недееспособность, является крайне важным экономическим вопросом.
Литература
1. Tinetti ME, Inouye SK, Gill TM et al (1995) Shared risk factors for falls, incontinence, and functional dependence. Unifying the approach to geriatric syndromes. JAMA 273(17):1348-1353
2. Bischoff HA, Stahelin HB, Urscheler N et al (1999) Muscle strength in the elderly: its relation to vitamin D metabolites. Arch Phys Med Rehabil 80(1):54-58
3. Pfeifer M, Begerow B, Minne HW et al (2000) Effects of a shortterm vitamin D and calcium supplementation on body sway and secondary hyperparathyroidism in elderly women. J Bone Miner
Res 15(6):1113-1118
4. Dukas L, Staehelin HB, Schacht E, Bischoff HA (2005) Better functional mobility in community-dwelling elderly is related to Dhormone serum levels and a to a daily calcium intake. Nutr Health
Aging 9(5):347-351
5. Bischoff HA, Stahelin HB, Dick Wet al (2003) Effects of vitamin D and calcium supplementation on falls: a randomized controlled trial. J Bone Miner Res 18:343-351
6. Gallagher JC (2004) The effects of calcitriol on falls and fractures and physical performance tests. J Steroid Biochem Mol Biol 89-90:497-501
7. Dukas L, Bischoff HA, Lindpaintner LS, Schacht E, Birkner-Binder D, Damm T, Thalmann B, Stahelin HB (2004) Alfacalcidol reduces the number of fallers in a community-dwelling elderly
population with a minimum calcium intake of 500 mg daily. J Am Geriatr Soc 52:1-7
8. Faulkner KA, Cauley JA, Zmuda JM, Landsittel DP, Newman AB, Studenski SA, Redfern MS, Ensrud KE, Fink HA, Lane NE, Nevitt MC (2006) Higher 1,25-dihydroxyvitamin D3 concentrations
associated with lower fall rates in older community-dwelling women. Osteoporos Int 17(9):1318-1328
9. Boland R (1986) Role of vitamin D in skeletal muscle function. Endocr Rev 7:434-447
10. Sorensen OH, Lund BI, Saltin B et al (1979) Myopathy in bone loss of aging: improvement by treatment with 1 alphahydroxycholecalciferol and calcium. Clin Sci 56(2):157-161
11. Endo I, Inoue D, Mitsui T, Umaki Y, Akaike M, Yoshizawa T, Kato S, Matsumoto T (2003) Deletion of vitamin D receptor gene in mice results in abnormal skeletal muscle development with
deregulated expression of myoregulatory transcription factors. Endocrinology 144(12):5138-5144
12. Dukas L, Schacht E, Stahelin HB (2005) In elderly men and women treated for osteoporosis a low creatinine clearance of Osteoporos Int <65 ml/min is a risk factor for falls and fractures. Osteoporos Int 16(12):1683-1690
13. Dukas LC, Schacht E, Mazor Z, Stahelin HB (2005) A new significant and independent risk factor for falls in elderly men and women: a low creatinine clearance of less than 65 ml/min.
Osteoporos Int 16(3):332-338
14. Dukas L, Schacht E, Mazor Z, Stahelin HB (2005) Treatment with alfacalcidol in elderly people significantly decreases the high risk of falls associated with a low creatinine clearance of <65 ml/min.
Osteoporos Int 16(2):198-203
15. Gallagher JC, Rapuri PB, Smith LM (2007) An age related decrease in creatinine clearance is associated with an increase in number of falls in untreated women but not in women receiving
calcitriol. J Clin Endocrinol Metab 92:51-58
16. Ensrud KE, Lui L-Y, Taylor BC, Ishani A, Shlipak MG, Stone KL, Cauley JA, Jamal SA, Antoniucci DM, Cummings SR, for the Study of Osteoporotic Fractures Research Group (2007) Renal
function and risk of hip and vertebral fractures in older women. Arch Intern Med 167:133-139
17. Cockcroft DW, Gault MH (1976) Prediction of creatinine clearance from serum creatinine. Nephron 16(1):31-41
18. Podsialdo D, Richardson S (1991) The timed "Up & Go": a test of basic functional mobility for frail elderly persons. J Am Geriatr Soc 39(2):142-148
19. Mathias S, Nayak US, Isaacs B (1986) Balance in elderly patients: the "get-up and go" test. Arch Phys Med Rehabil 67(6):387-389
20. Zhu K, Devine A, Prince RL (2008) Timed Up and Go Test and BMD as predictors of fractures: a 10-year longitudinal study. J Bone Min Res 23:s119
21. Guralnik JM, Ferrucci L, Simonsick EM, Salive ME, Wallace RB (1995) Lower-extremity function in persons over the age of 70 years as a predictor of subsequent disability. N Eng J Med
332:556-561
22. Gill TM, Williams CS, Tinetti ME (1995) Assessing risk for the onset of functional dependence among older adults: the role of physical performance. J Am Geriatr Soc 43:603-609
23. Runge M, Rehfeld G, Resnicek E (2000) Balance training and exercise in geriatric patients. JMusculoskel Neuronal Interact 1:54-58
24. Winer BJ (1971) Statistical principles in experimental design, 2nd edn. McGraw Hill, New York, p 514
25. Skeleton DA, Greig CA, Davies JM (1994) Strength, power and related functional ability of healthy people aged 65-89 years. Age Ageing 23:371-377
26. Danneskiold-Sams?e B, Kofod V, Munter J (1984) Muscle strength and functional capacity in 78-81 year old men and women. Eur J Appl Physiol 52:310-314
27. McMurdo ME (1997) Physical activity and health in old age. Scott Med J 42(5):154-155
28. Rejeski WJ, Mihalko SL (2001) Physical activity and quality of life in older adults. J Gerontol A Biol Sci Med Sci 56:23-35 Spec No 2(2)
29. Lee MS, Tanaka K (1997) Significance of health fitness appraisal in an aging society. Appl Human Sci 16(4):123-131
30. Schacht E (1999) Rationale for treatment of involutional osteoporosis in women and for prevention and treatment of corticosteroid-induced osteoporosis with alfacalcidol. Calcif Tissue Int 65:317-327
31. Lau KHW, Baylink DJ (1999) Vitamin D therapy of osteoporosis:
plain vitamin D therapy versus active vitamin D analog (Dhormone) therapy. Calcif Tissue Int 65:295-306
32. Richy F, Deroisy R, Lecart M-P, Hanssens L, Mawet A, Reginster J-Y (2005) D-hormone analog alfacalcidol: an update on its role in post-menopausal osteoporosis and rheumatoid arthritis management. Aging Clin Exp Res 17:133-142
33. Schacht E, Richy F, Reginster J-Y (2005) The therapeutic effects of alfacalcidol on bone strength, muscle metabolism and prevention of falls and fractures. J Musculoskelet Neuronal Interact
5:273-284
34. Tinetti ME, Williams CS (1998) The effect of falls and fall injuries on functioning in community-dwelling older persons. J Gerontol A Biol Sci Med Sci 53(2):M112-M119
35. Stein MS, Wark JD, Scherer SC, Walton SL, Chick P, Di Carlantonio M, Zajac JD, Flicker L (1999) Falls related to vitamin D and parathyroid hormone in Australian nursing home and hostel. J Am Ger Soc 47:1195-1201
36. Klawansky S, Komaroff E, Cavanaugh PF, Mitchell DY, Gordon MJ, Connelly JE, Ross SD (2003) The relationship between age, renal function and bone mineral density in the US population.
Osteoporos Int 14:570-576
37. Jassal SK, von Muhlen D, Barrett-Connor E (2007) Measures of renal function, BMD, bone loss, and osteoporotic fracture in older adults: the Rancho Bernardo study. J Bone Miner Res
22:203-210
38. Trombetti A, Stoermann-Chopard C, Ferrari S, Saudan P, Chevalley T, Binet I, Uebelhart B, Rizzoli R, Martin PY (2003) Pravention von Knochenkomplikationen bei Patienten mit chronischer Niereninsuffizienz (1.Teil). Swiss Med Forum 11:260-266
39. Slovik DM, Adams JS, Neer RM et al (1981) Deficient production of 1,25-dihydroxyvitamin D in elderly osteoporotic patients. N Engl J Med 305:372-374
40. Oelzner P, Muller A, Deschner F, Huller M, Abendroth K, Hein G et al (1998) Relationship between disease activity and serum levels of vitamin D metabolites and PTH in rheumatoid arthritis.
Calcif Tissue Int 62:193-198
41. Epstein S, Bryce G, Hinman JW et al (1986) The influence of age on bone mineral regulating hormones. Bone 7:421-425
42. Tsai KS, Heath H III, Kumar R et al (1984) Impaired vitamin D metabolism with aging in women: possible role in pathogenesis of senile osteoporosis. J Clin Invest 73:1668-1672
43. Dukas L, Bischoff HA, Schacht E et al (2002) Normal 25 (OH) vitamin D serum levels do not exclude D-hormone deficiency in community-dwelling elderly. Osteoporos Int 13(1): S35
44. Peacock M, Heyburn P (1977) Effect of vitamin D3 metabolites on proximal muscle weakness. Calcif Tiss Res 24(Suppl):R20- R23
45. Verhaar HJJ, Samson MM, Jansen PAF et al (2000) Muscle strength, functional mobility and vitamin D in older women. Aging Clin Exp Res 12:455-460
46. Dhesi JK, Bearne LM, Monitz C, Hurley MV, Jackson SHD, Swift CG, Allain TJ (2002) Neuromuscular and psychomotor function in elderly subjects who fall and the relationship with vitamin D status. J Bone Miner Res 17:891-897
47. Koike T, Okawa T, Wada M, Kita T, Takaoka K (2003) Effects of a long-term alfacalcidol or calcitonin administration on body sway in Japanese elderly women. J Bone Miner Res 18(S2)):S168
48. Gryfe CI, Amies A, Ashley MJ (1997) A longitudinal study of falls in an elderly population: incidence and morbidity. Age Aeing 6(4):201-210
49. Liu S, Tang W, Zhou J et al (2006) Fibroblast growth factor 23 is a counter-regulatory phosphaturic hormone for vitamin D. J Am Soc Nephrol 17:1305-1315
50. Cappola AR, Xue QL, Ferrucci L, Guralnik JM, Volpato S, Fried LP (2003) Insulin-like growth factor I and interleukin-6 contribute
synergistically to disability and mortality in older women. J Clin Endocrinol Metab 88:2019-2025
51. K/DOQI Practice guidelines for bone metabolism and disease in chronic kidney disease. Am J Kidney Dis 2003;42(4, S3):S7- S28
52. Zofkova I, Kancheva RL, Bendlova B (1997) Effect of 1,25(OH)2 vitamin D3 on circulating insulin-like growth factor-I and ?2 Osteoporos Int microglobulin in patients with osteoporosis. Calcif Tissue Int 60:236-239
53. Jorde R, Waterloo K, Saleh F, Haug E, Svartberg J (2006) Neuropsychological function in relation to serum parathyroid hormone and serum 25-hydroxyvitamin D levels. The Tromso study. J Neurol 253(4):464-470
54. Miya K, Morimoto S, Fukuo K, Imanaka S, Shiraishi T, Yamamato H, Kitano S, Miyashita Y, Inoue T (1991) Hirotani J. Nippon Ronen Igakkai Zasshi 28(1):34-39
55. Przybelski RJ, Binkley NC (2007) Is vitamin D important for preserving cognition? A positive correlation of serum 25- hydroxyvitamin D concentration with cognitive function. Arch Biochem Biophys 460(2):202-205
56. Burne TH, McGrath JJ, Eyles DW, Mackay-Sim A (2005) Behavioural characterization of vitamin D receptor knockout mice. Behav Brain Res 157(2):299-308
57. Wiese RJ, Uhland-Smith A, Ross TK, Prahl JM, DeLuca HF (1992) Up-regulation of the vitamin D receptor in response to 1,25-dihydroxyvitamin D3 results from ligand-induced stabilization. J Biol Chem 267:20082-20086
58. Francis RM, Peacock M, Barkworth SA (1984) Renal impairment and its effects on calcium metabolism in elderly women. Age Ageing 13:14-20
59. Nguyen TV, Eisman JA, Kelly PJ, Sambrook PN (1996) Risk factors for osteoporotic fractures in elderly men. Am J Epidemiol 144:255-263
Источник РМЖ том 18, № 15













