Хондроитин сульфат (Структум) в лечении остеоартроза: патогенетическое действие и клиническая эффективность
Чичасова Н.В.
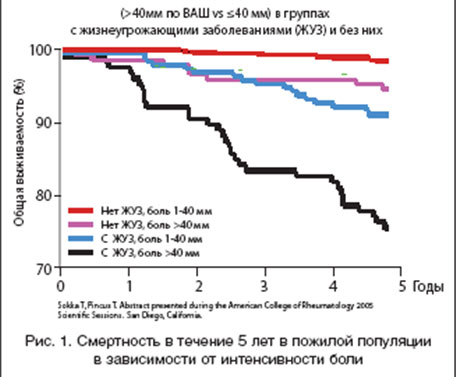
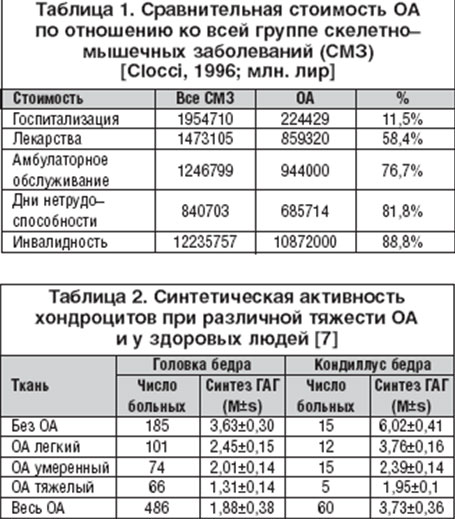
Лечение остеоартроза (ОА) является весьма актуальной проблемой. Связано это со многими факторами. Во-первых, ОА - самое частое заболевание суставов, клинические симптомы которого в целом наблюдаются более чем у 10-20% населения земного шара [1]. Рентгенологические признаки ОА обнаруживаются значительно чаще, чем клинические, частота и тех и других нарастает с возрастом. Например, в США до 70% населения в возрасте старше 65 лет имеют определенные радиологические признаки заболевания [2]. Но развиваться ОА может в любом возрасте. Широкомасштабное исследование в 7 городах бывшего СССР лиц старше 15 лет (41348 человек) выявило клинические проявления ОА у 6,43% [3]. Кроме того, ОА является одной из основных причин преждевременной потери трудоспособности, уступая в этом только ишемической болезни сердца. Известно, что развитие ОА у женщин приводит к уменьшению продолжительности жизни в среднем на 10-15 лет. Показано, что уменьшение продолжительности жизни у пожилого контингента в большей степени зависит от интенсивности боли (рис. 1), чем от наличия или отсутствия жизнеугрожающих заболеваний (например, ИБС, артериальной гипертензии и др.) [4]. При оценке выживаемости 1525 больных, из которых 370 страдали OA (24%), 246 - сердечно-сосудистыми болезнями (16%), а 109 имели сочетание OA и сердечно-сосудистых заболеваний, оказалось, что относительный риск (95% CI) 5-летней смерти больных OA, имевших интенсивность боли >40 мм, по сравнению с больными, имевшими боль <40 мм, был 4,2 (1,6-12), при отсутствии различий в возрасте и поле [4]. В таблице 1 приведены данные о сравнительной стоимости ведения больных ОА по отношению к остальным заболеваниям костно-мышечной системы. Все это послужило тому, что по социальной и экономической значимости Всемирная Организация Здравоохранения определила проблему ОА, как одну из основных в ходе Декады костей и суставов 2000-2010 гг.
Хотя ОА может развиваться в различных возрастных группах, но отчетливое нарастание его частоты именно у лиц пожилого возраста также сопряжено с трудностями терапевтических подходов: ухудшение переносимости многих обезболивающих средств, наличие сопутствующих заболеваний и необходимость в использовании лекарств для их лечения. Трудности лечения ОА заключаются также не только в пожилом возрасте большинства пациентов, но и в необходимости длительного многолетнего лечения при трудности оценки эффекта терапии.
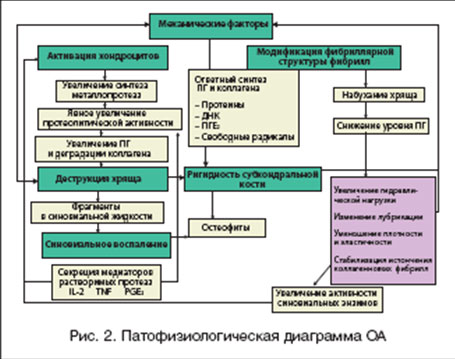
Многие годы считалось, что ОА является следствием возрастного "изнашивания" хряща. Однако патогенез ОА намного сложнее (рис. 2). Данная патология рассматривается, как гетерогенная группа заболеваний суставов, патоморфологически характеризующихся фокальным разрушением суставного хряща, изменениями в субхондральной кости (включая микропереломы и образование кист) и образованием остеофитов, а также сопутствующим поражением других компонентов сустава (синовиальная оболочка, связки, капсула и периартикулярные мышцы) [5]. Рентгенологически ОА характеризуется сужением суставной щели, остеофитозом. субхондральным склерозом, образованием кист и неровными костными контурами.
Основными звеньями патогенеза ОА являются дегенеративные процессы в хрящевой ткани, развитие воспаления в синовиальной оболочке и патологические процессы в субхондральной кости. Нормальный метаболизм хрящевой ткани изменяется с превалированием катаболических процессов над анаболическими [6]. Одним из самых важных компонентов матрикса хряща являются протеогликаны (макромолекулы, в которых стержневой белок связан с одной или несколькими цепями гликозаминогликанов - ГАГ). ГАГ разделяют на 2 группы: несульфатированные (гиалуроновая кислота, хондроитин) и сульфатированные (хондроитин-сульфат и кератан-сульфат). Совместно с коллагеновыми волокнами ГАГ обеспечивают устойчивость хряща к внешним воздействиям. При ОА синтез хондроцитами ГАГ снижается (табл. 2) [7]. Снижается синтез коллагена II типа с повышением синтеза коллагена I, III, X типов. Активация хондроцитов приводит не только к ухудшению синтеза полноценных компонентов матрикса хряща, но и к повышенной экспрессии провоспалительных цитокинов (интелейкина-1, интелейкина-6, фактора некроза опухоли-a), циклооксигеназы II типа (ЦОГ-2), оксида азота [8]. Важная роль в деградации хряща отводится матриксным металлопротеазам (ММП) [9], основными мишенями которых становятся структурные компоненты экстрацеллюлярного матрикса (протеогликаны и коллаген II типа). Кроме того, коллагенолитические ММП влияют и на функциональную активность клеток субходральной кости, усугубляя остеоклаcтическую резорбцию [10].
При развитии дегенеративных процессов в хрящевой ткани вторично страдают и все остальные структуры сустава: в синовиальной оболочке развивается воспаление (синовит), в подлежащей кости увеличиваются деструктивные процессы (субхондральные кисты) и параллельно с ними идет компенсационное разрастание костной ткани (остеофиты), ослабевает сухожильно-связочный аппарат, что приводит к нестабильности сустава.
Все эти факторы приводят к развитию основного клинического проявления ОА - болевого синдрома, поэтому в первую очередь больным назначается анальгетическая терапия. Рекомендации ВОЗ по лечению ОА динамически изменялись с 1995 г. по 2003 г., отражая получение новых данных об эффективности или недостаточной эффективности различных лечебных мероприятий (табл. 3). На современном этапе считается, что обезболивание при ОА надо начинать с симптом-модифицирующих средств - назначения ацетаминофена (парацетамола), проведения ортопедических мероприятий и назначения нестероидных противовоспалительных препаратов (НПВП) из группы ЦОГ-2 селективных ингибиторов. Далее назначаются структурно-модифицирующие препараты, и только при необходимости назначают неселективные НПВП. К сожалению, в реальной практике НПВП используются очень широко. И врачей, и пациентов привлекает быстрота анальгетического эффекта. Однако следует учитывать, что НПВП наиболее эффективны при выраженных явлениях воспаления в синовиальной оболочке, но дают либо очень кратковременный эффект, либо вообще не эффективны при других причинах болевого синдрома (в частности, при нейропатическом или сосудистом характере болей). Ранее считалось, что подавление образования провоспалительных простагландинов, цитокинов, свободных кислородных радикалов, протеаз (то есть подавление синовита) при назначении НПВП может иметь и некоторое "хондропротективное" действие [11,12]. Позднее появились новые данные, которые освещают негативное влияние неселективных НПВП на синтез матрикса хряща. Некоторые НПВП (ибупрофен, салицилаты, индометацин) при систематическом применении в течение 4-6 мес. ускоряют деструкцию хряща, угнетая синтез простагландинов, пролиферацию хондроцитов, ингибируя ферменты, необходимые для синтеза гликозаминогликанов (ГАГ) [13,14]. Известно, что ГАГ играют центральную роль в супрамолекулярной организации агрегатов простагландинов, и вследствие этого - в биомеханической функции хряща. Применение неселективных НПВП приводит к выраженному снижению содержания гиалуронана в хряще при экспериментальном ОА [15] и в хряще человека [16], не зависящее от возраста пациентов [17,18]. Для некоторых неселективных НПВП показано зависящее от дозы различие воздействия на катаболические и анаболические процессы в хряще. Введение низких доз НПВП (5 мг/кг тиапрофеновой кислоты) в эксперименте in vitro приводило к снижению деградации протеогликановых агрегатов и повышению синтетической активности хондроцитов, а введение более высоких (терапевтических) доз вызывало ускорение катаболических процессов и потерю протеогликанов из хрящевой ткани [19]. Аналогичные данные были получены для диклофенака и индометацина. Кроме того, было показано, что при длительном лечении диклофенаком и тиапрофеновой кислотой происходит гибель остеоцитов в субхондральной кости [20]. Все это свидетельствует, что НПВП при ОА следует использовать короткими курсами и в низких дозах. Однако такой подход не всегда приводит к удовлетворительному обезболиванию больных ОА.
Следует ясно представлять, что основным патогенетическим механизмом, приводящим к развитию болевого синдрома, является постепенная деградация и снижение синтеза матрикса хряща, потеря им своих амортизационных свойств, изменение свойств синовиальной жидкости (снижение вязкости и эластичности), увеличение нагрузки на субхондральную кость с нарушением баланса костного обмена, отеком костной ткани в подлежащей кости, развитием остеита и остеофитов. Изменения субхондральной кости, видные на рентгенограммах у больных с установленным ОА, скорее, позволяют предполагать их важную роль в развитии этого заболевания, чем рассматривать их как следствие повреждения хряща. Известно, например, что целостность хряща зависит от механических свойств подлежащей кости. Так, изменение субхондральной кости (возможно после повторных микропереломов) вызывает отсутствие абсорбции давления. Роль обмена субхондральной кости при ОА подтверждается в исследованиях in vivo на моделях морских свинок, где отчетливо появлялись изменения в ней раньше, чем развивались изменения в хряще; проспективными исследованиями, в которых костные изменения, определяемые сцинтиграфически, предсказали рентгенографическое прогрессирование в коленных суставах и суставах кистей; увеличенной экспрессией в кости металлопротеиназ матрикса и щелочной фосфатазы при ОА тазобедренных суставов у человека [21].
Хондроитин сульфат является естественным компонентом элементов хряща, играет биологически активную роль во многих процессах метаболизма различных структур сустава. Препарат Структум (хондроитин сульфат) уже давно используется в клинической практике, в том числе и в нашей стране. Фармакокинетические исследования показали, что при приеме внутрь дозы 800-1000 мг/сут. он хорошо абсорбируется и обнаруживается в высоких концентрациях в синовиальной жидкости [22] (прием 500 мг/сут. ХС не сопровождается таким эффектом). Механизм действия ХС многогранен. Очевидно, что его клиническая эффективность определяется влиянием на различные механизмы развития и прогрессирования ОА.
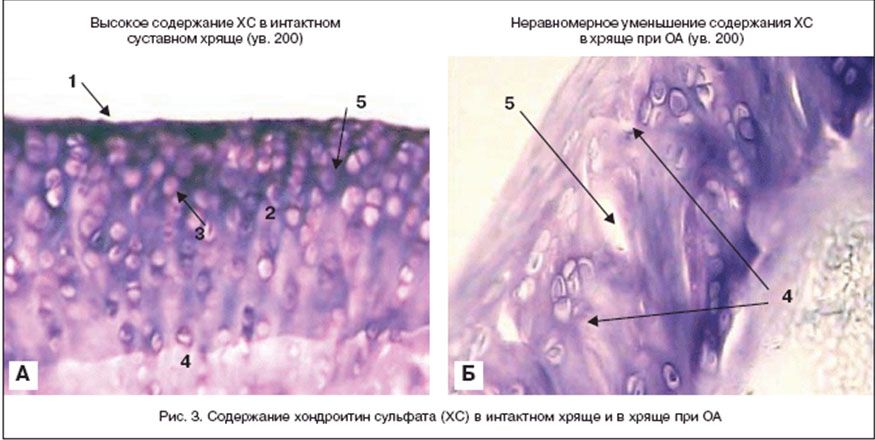
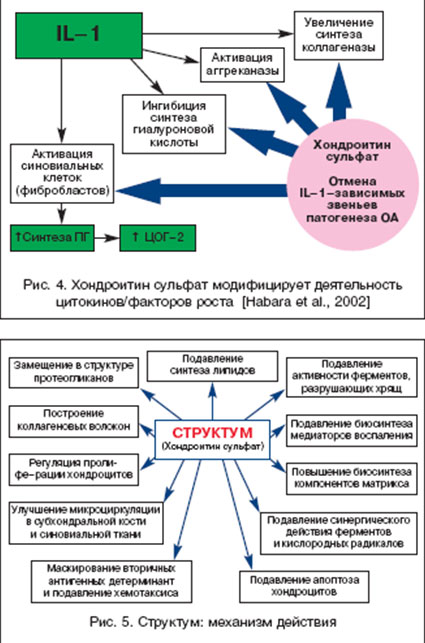
Нарушения обмена и активности хондроцитов при ОА приводит к повреждению матрикса хряща с уменьшением содержания хондроитин сульфата и протеогликанов (рис. 3). С этими процессами неразрывно связана гиперэкспрессия провоспалительных медиаторов, приводящая к воспалительно-дегенеративным процессам в различных структурах сустава и апоптозу хондроцитов. Среди провоспалительных цитокинов при ОА ведущая роль принадлежит интерлейкину 1 (IL-1). Прием Структума в терапевтической дозе 1000 мг/сут. в течение первых 3 месяцев приводит не только к восполнению синтеза ГАГ, но и к отмене IL-1-зависимых патологических эффектов (рис. 4). Это приводит к восстановлению синтетических процессов, уменьшению воспаления и купированию боли, связанной с воздействием агрессивных цитокинов, свободных радикалов, фрагментов фибронектина и металлопротеаз (ММР) на обнаженные болевые рецепторы при дефиците гиалуроновой кислоты. Структум способен подавлять синтез агрессивных ММР и активировать синтез ингибиторов ММР, что также способствует восстановлению равновесия между анаболическими и катаболическими процессами в матриксе хряща. Особая роль в патогенезе ОА принадлежит оксиду азота (NO), который способен ингибировать синтез макромолекул хряща, увеличивать активность ММР матрикса, увеличивать количество простагландинов и лейкотриенов, уменьшать выработку антивоспалительных цитокинов, способствовать апоптозу хондроцитов [23]. Показано, что хондроитин сульфат подавляет NО-индуцированный апоптоз хондроцитов [24]. Кроме того, использование хондроитин сульфата улучшает микроцируляцию субхондральной кости за счет ингибиции синтеза липидов, связывания Е-селектина, мобилизации фибрина, липидов и холестерина в кровеносных сосудах субхондральной кости.
Таким образом, хондроитин сульфат воздействует практически на все основные ключевые патогенетические механизмы развития ОА (рис. 5).
Оценка эффективности медленнодействующих препаратов, к каковым относится Структум (хондроитин сульфат), весьма сложна и кропотлива. Основной целью лечения больного ОА является улучшение качества его жизни за счет уменьшения боли (симптом-модифицирующий эффект) и улучшения функциональных возможностей. В соответствии с современными рекомендациями эти параметры регистрируются с использованием стандартных методов. Оценка боли проводится с использованием визуальных аналоговых шкал (ВАШ) в мм или в баллах, а функциональные возможности пациента оцениваются по индексам Леккена или WOMAC. Следует отметить, что эти методы основаны на субъективных ощущениях больного, что может влиять на статистически обрабатываемые данные. Степень симптоматического эффекта медленнодействующих препаратов можно оценить по изменению потребности больного в приеме обезболивающих средств. Для оценки структурно-модифицирующего действия необходимо проведение строго контролируемых длительных (многолетних) исследований рентгенологических параметров, отражающих прогрессирование ОА: изменение величины суставной щели (отражает степень деградации хряща), состояние субхондральной кости, наличие и величина остеофитов.
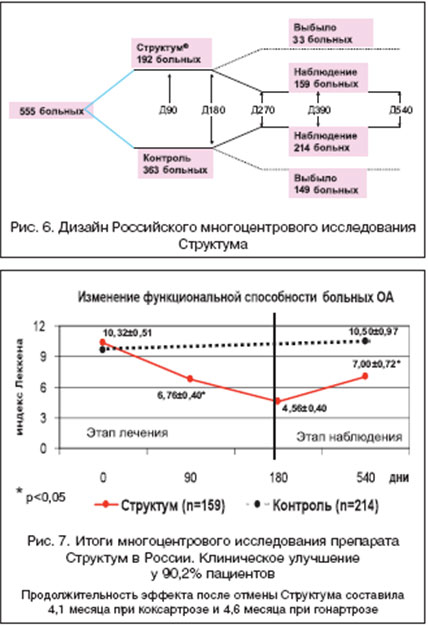
Симптом-модифицирующий эффект Структума. Еще в начале 90-х годов прошлого столетия в двойном слепом плацебо-контролируемом исследовании [25] с использованием хондроитина сульфата курсом в 3 месяца, с последующим 2-месячным периодом без лечения, было показано снижение потребления НПВП среди пациентов с гонартрозом, как во время курса терапии, так и в период после ее окончания. Первый опыт применения Структума в нашей стране в лечении гонартроза в течение 6 месяцев (и 3 месяца наблюдения после отмены препарата) показал, что прием суточной дозы 1,0 г Структума уменьшает боль и потребность в НПВП, улучшает функциональное состоянии суставов, повышает качество жизни. Важным оказалось сохранение эффекта Структума в течение 3-х месяцев наблюдения по окончанию его приема [26]. В отечественном многоцентровом (11 центров в различных городах РФ) открытом 6-месячном рандомизированном исследовании [27] было решено оценить эффект и переносимость Структума у больных ОА коленных и тазобедренных суставов. Дизайн исследования представлен на рисунке 6. Все больные в течение 6 месяцев получали либо только назначенную ранее суточную дозу НПВП, либо НПВП и Структум в первые 3 недели 1,5 г и далее по 1,0 г/сут. до 6 месяцев лечения. Затем больные наблюдались длительный период времени (как видно из рисунка 6, весь период исследования занял 540 дней).
Основные результаты этого исследования:
1. Клиническое улучшение зарегистрировано у 90% больных гонартрозом и у 90,2% больных коксартрозом на фоне лечения Структумом.
2. Достоверное уменьшение боли через 6 месяцев у больных, получавших Структум: при гонартрозе с 61,2±2,0 до 26,0±2,0 мм; при коксартрозе с 60,0±3,0 до 27,0±2,0 мм (т.е. более чем в 2,5 раза).
3. Исчезновение боли в покое у 57% больных с гонартрозом и у 46% больных с коксартрозом.
4. Улучшение функциональной способности больных (рис. 7) при приеме Структума: при гонартрозе индекс Леккена уменьшился через 3 месяца в 1,5 раза и при коксартрозе в 1,6 раза; через 6 месяцев индекс Леккена уменьшился соответственно в 2 и 2,5 раза.
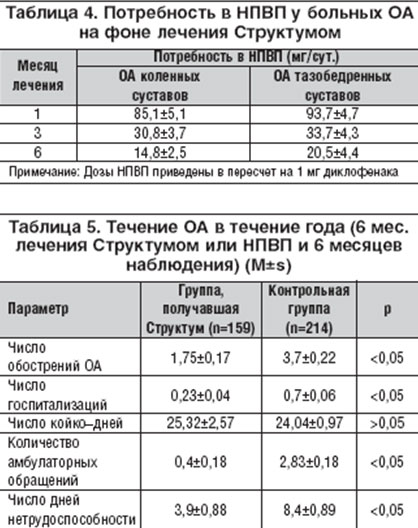
5. Прием Структума уменьшал потребность больных в НПВП (табл. 4) через 3 месяца лечения при гонартрозе и при коксартрозе в 2,8 раза (p<0,01), через 6 месяцев - при гонартрозе в 5,7 раза (p<0,01) и при коксартрозе в 4,6 раза (p<0,01). В целом через 6 месяцев 55% больных отказались от приема НПВП.
6. Отмечена хорошая переносимость Структума у 97,9% больных (4 отмены из-за гастралгии, обострения хронического холецистита, крапивница через 4 месяца приема препарата и отеки голени). Доказать связь этих проявлений непереносимости с приемом именно Структума не представляется возможным.
7. Отмечено сохранение достигнутого эффекта при приеме Структума в среднем в течение 4,6 месяца при ОА коленных суставов и в течение 4,1 месяца при ОА тазобедренных суставов.
Кроме того, у больных ОА коленных и тазобедренных суставов, включенных в Российское многоцентровое исследование Л.И. Алексеевой и соавт. [28], было проведено фармакоэкономическое исследование: насколько оправдано с экономической точки зрения использование препаратов с медленным развитием эффекта, требующих непрерывного использования в течения многих месяцев. Оценивались прямые расходы на лекарственную терапию ОА (стоимость Структума и НПВП), расходы на лечение побочных эффектов; стоимость медикаментов и госпитализаций, медицинских услуг оценивали по медико-экономическим стандартам. Прямые расходы на лекарственную терапию ОА увеличиваются больше при назначении Структума, чем при монотерапии НПВП. Однако при использовании Структума значительно снижаются расходы и на приобретение НПВП, и на лечение связанных с ними побочных реакций, кроме того, уменьшилось число госпитализаций и амбулаторных посещений (табл. 5). Так что эффективность на единицу затрат (для расчета использован специальный программный комплекс ПРИНН) значительно возрастала при использовании Структума.
Симптом-модифицирующий эффект Структума зарегистрирован во многих зарубежных рандомизированных контролируемых исследованиях: достоверное уменьшение боли по сравнению с монотерапией НПВП [29,30], улучшение функциональной способности суставов, хорошая переносимость, в связи с чем было проведено 2 мета-анализа (напомним, что мета-анализ контролируемых клинических исследований обладает наибольшей степенью доказательности), объединивших данные по изучению клинической эффективности и переносимости Структума у 776 больных ОА коленных и тазобедренных суставов, включенных в двойные слепые контролируемые исследования [31,32]. Все полученные данные свидетельствуют о наличии у Структума собственного анальгетического и противовоспалительного действия, что проявляется в уменьшении клинических признаков ОА (боль, скованность, ограничение движений) на фоне уменьшения суточной дозы или отмены НПВП и других анальгетиков, а также о хорошей переносимости препарата. Эти данные нашли отражение в рекомендациях EULAR 2003, 2005 и 2007 гг. [33-35].
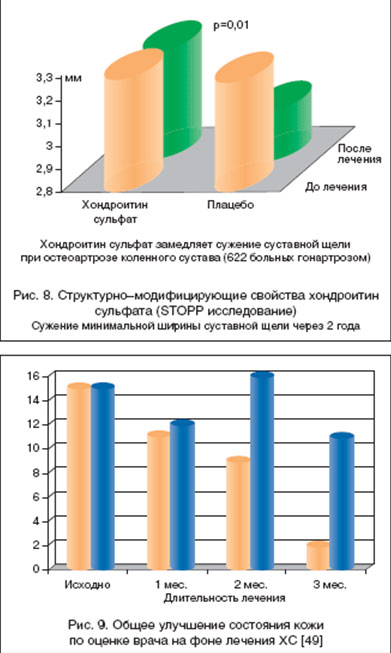
Структурно-модифицирующий эффект Структума. Возможность Структума влиять на метаболизм хряща была продемонстрирована в годичном плацебо-контролируемом исследовании у больных ОА коленных суставов [36]: авторы показали стабильность рентгенологически определяемой суставной щели у больных, получавших Структум, тогда как в контрольной группе отмечалось сужение суставной щели. Кроме того, у больных, получавших Структум, отмечалось достоверное снижение маркеров деградации хряща (кератан сульфата) и маркеров деструкции костной ткани (пиридинолина и дезоксипиридинолина) (p<0,001), а в группе, получавшей плацебо - повышение этих показателей. Замедление сужения суставной щели коленного сустава у 622 больных показано и в недавно законченном плацебо-контролируемом 2-летнем исследовании (рис. 8). Появились данные и о возможности уменьшать прогрессирование (появление новых эрозий) при ОА суставов пальцев [37]. Однако если в рекомендациях EULAR [38-40] для ОА коленных и тазобедренных суставов отмечается и симптом-модифицирующий, и структурно-модифицирующий эффект Структума, подтвержденный данными еще двух мета-анализов [41,42], то для узелкового ОА пока не разработаны четкие критерии оценки прогрессирования деградации хряща и кости, в связи с чем потребуются дополнительные исследования для убедительного доказательства возможности улучшить течение ОА и этой локализации.
Длительное время лечение ОА ограничивалось применением обезболивающих и противовоспалительных препаратов. Использование лекарственных средств других групп, влияющих, возможно, на патогенез заболевания, оставалось ограниченным из-за отсутствия убедительных доказательств их эффективности. Расширение и углубление представлений о природе заболевания и тонких механизмах его развития привело к пересмотру точки приложения и оценки патогенетической значимости ряда медленнодействующих препаратов, к которым относится и Структум (хондроитин сульфат).
В последние годы большое внимание привлекает к себе патологические эффекты фактора транскрипции NF- kB. Были получены экспериментальные данные об ингибиции NF- kB (метод флуоресценции) в гепатоцитах при использовании ХС [43]. Поэтому высказывались предположения, что ХС может использоваться и при других заболеваниях, так как:
o в хряще некоторые эффекты ХС могут быть связаны с ингибицией фактора ядерной транслокации NF- kB
o в синовиальной мембране подавление отека и эффузии ХС м.б. связано с ингибицией ядерной транслокации NF-kB
o in vivо ХС предупреждает ядерную транслокацию NF- k B в гепатоцитах
o эти исследования подтверждают гипотезу, что ХС может редуцировать активацию NF- kB и в других тканях.
Среди болезней человека, которые связаны с активацией NF-kB, наибольшее внимание привлекают болезнь Альцгеймера, атеросклероз, болезнь Паркинсона и кожный псориаз. В прошлом году были опубликованы данные об эффектах ХС в эксперименте на кроликах, имеющих артрит и нарастание сосудистой патологии вследствие атеросклероза [44]: ХС снижал маркеры системного воспаления (IL-6 и СРБ), приводил к отчетливому снижению проявлений атеросклероза при рестенозе бедренной артерии и уменьшал проявления атеросклероза в аорте.
Также в экспериментальных исследованиях было показано, что ХС способен улучшать состояние дермальных кератиноцитов и фибробластов: он ингибировал опосредованную амфирегулином пролиферацию кератиноцитов [45], дозозависимо увеличивал продукцию нативных гиалуронатов и ГАГ в дермальных фибробластах человека [46], кератиноцитах [47] и в экстрацеллюлярном матриксе [46]. Кроме того, ХС, являясь большой гигроскопической молекулой, способствует удержанию воды клетками, улучшая гидратацию кожи [48].
Было проведено и рандомизированное плацебо-контролируемое 3-месячное исследование эффективности ХС у 129 пациентов с гонартрозом и кожным псориазом [49]. По этим данным, помимо симптом-модифицирующего эффекта ХС в отношении клинических проявлений ОА, было выявлено и достоверное улучшение плантарного псориаза (по индексу тяжести - PASI и при оценке общего состояния больных по ВАШ) (рис. 9). Авторы заключают, что у пациентов с сочетанием ОА и кожного псориаза Структум (ХС) может быть препаратом выбора. Остается не вполне ясным, оказывает ли ХС у больных с ОА и сопутствующим кожным псориазом непосредственно нормализующее влияние на клетки дермы, или улучшение проявлений псориаза связано с уменьшением использования НПВП по мере проявления симптоматического эффекта ХС. Тем не менее эти данные очень интересны. По-видимому, последующие исследования позволят определить степень эффективности Структума (ХС) и при других тяжелых болезнях.

Литература
1. Smith M.M., Ghosh P. "Osteoarthritis: Current status and future directions" APLAR J. Rheum., 1998, V.2: 27-53
2. Lawrence RC, Brummer Jm, Bier F. "Osteoarthritis prevalence in the population and relationship between symptoms and x-ray changes" Ann Rheum Dis. 1966;25:1-24.
3. Беневоленская Л.И., Бржезовский М.М. Эпидемиология ревматических болезней. Москва, Медицина, 1988.
4. Pincus T, Sokka T. Abstract presented during the American College of Rheumatology 2005 Scientific Sessions. San Diego, California.
5. March LM., Bachmeier CJ. "Economics of osteoarthritis: a global perspective" Baill. Clin. Rheum., 1997, 11: 817-834
6. Pelletier JP., Martel-Pelletier J., Howell DS. "Etiopathogenesis of osteoarthritis" In: Koopman WJ., Ed Arthritis and Allied Conditions. A Textbook of Rheumatology 13th edn. Baltimore: Williams & Wilkins 1969/1984/1997.
7. "Osteoarthritis. Clinical and Experimental aspects" Ed.J.-E. Reginster, J.-P. Pelletier, Y. Henrotin. Springer, 1999.
8. Е.Л. Насонов, Л.И. Алексеева "Хондроитин сульфат (Структум) при лечении остеоартроза: патогенетическое обоснование и клиническая эффективность" Тер. Архив, 2001, №11, стр. 87-89
9. Murphy G., Lee MH. "What are the roles of metalloproteinases in cartilage and bone damage?" Ann. Rheum. Dis., 2005, 64: iv44-iv47
10. Andersen TL., del Carmen Ovejero M., Kirkegaard T. Et.al. "A scrutinu of matrix metalloproteinases in osteoclasts: evidence for heterogeneity and for the presence of MMPs synthesized by over cells" Bone, 2004, 35: 1107-1119
11. Насонова В.А., Сигидин Я.А. "Патогенетическая терапия ревматических заболеваний", М., 1985, 58-63
12. Haskisson E.C. "Clinical aspects of chondroprotection". Sem. Arthr. Rheum., 1990, V.19, 30-32
13. Brandt K.D. "The mechanism of action of nonsteroidal anti-inflammatory drugs". J. Rheum., 1991, V.18: 120-121
14. Ostensen M. "Cartilage changes in arthritis do non-steroidal antiphlogistics have positive or negative effects?" Tiddsskr-Nor-Laegeforen, 1991, V. 111, 838-840
15. Manicourt D.H., Pita J.C. "Progressive depletion of hyaluronic acid in early experimental osteoarthritis in dogs" Arthr. Rheum., 1988, 31: 538-544
16. Sweet M.B., Thonar E.J., Immelman A.R., Solomon L. "Biochemical changes in progressive osteoarthrosis" Ann. Rheum. Dis., 1977, 36: 387-398.
17. Rizkalla G., Reiner A., Bogoch T., Poole A.R. "Studies of the articular cartilage proteoglycan aggrecan in health and osteoarthritis. Evidence of molecular heterogeneity and extensive molecular changes in disease." J. Clin. Res., 1992, 90: 2268-2277.
18. Holmes M.W., Bayliss M.T., Muir H. "Hyaluronic acid in human articular cartilage. Age-related changes in content and size" Biochem. J., 1988, 250: 435-441
19. Мeyer-Carrive I., Ghosh P "Effects of tiaprofenic acid (Surgam) on cartilage proteoglycans in the rabbit joint immobilization model". Ann. Rheum. Dis., 1992, V.51:448-455
20. Vries B.J., Van der Berg W. "Impact of NSAIDS on murine antigen induced arthritis. A light microscopic investigation of anti-inflammatory and bone protective effects". J. Rheum., 1990, V 17: 295-303
21. Л.И. Алексеева "Остеоартроз - есть надежда на улучшение качества жизни" В мире лекарств, 1999, №2; http://medi.ru/doc/dislaimer.htm
22. Conte A., Volpi N., Palmieri L. Et.al. "Biochemical and pharmacokinetic aspects of oral treatment with chondroitin sulfate" Arzneim-Forsch.Drug Res., 1995,45: 918-925
23. Hashimoto S., Takahashi K., Amiel D. et.al. "Chondrocyte apoptosis and nutric oxide production in experimentally induced osteoarthritis" Arthr. Rheum. 1998, V.41: 1266-1274
24. Conrozier T. "Death of articular chondrocytes. Mechanisms and protection" Pres.Med., 1998; 21: 1859-1861
25. Muller-Fabender H, Bach GL, Haase W, et al. "Glucosamine sulfate compared to ibuprofen in osteoarthritis of the knee" Osteoarthritis Cartilage 1994;2(3):61-9
26. Алексеева Л.И., Беневоленская Л.И., Насонов Е.Л. и др. "Структум (хондроитин-сульфат) - новое средство для лечения остеоартроза"; Тер. архив, 1999, N5, с. 51-53
27. Насонова В.А., Алексеева Л.И., Архангельская Г.С. и др. "Итоги многоцентрового клинического исследования препарата Структум в России" Тер. архив, 2001,№11, стр. 84-87
28. Алексеева Л.И., Медников Б.Л, Пиявский С.А. и др. "Фармакоэкономические аспекты применения Структума при остеоартрозе"; Тер. архив, 2001, №11, стр. 90-92
29. Morreale P. Manopulo R. Galati M. et.al. "Comparison of the anti-inflammatory efficacy of chondroitin-sulfate and diclofenac sodium in patients with knee osteoarthritis." J. Rheum., 1996,23: 1385-1391.
30. Uebelchart D., Knussen O., Theiler R., "Ability of oral chondroitin-sulfate in painful knee osteoarthritis: a double-blind, placebo-controlled, multicenter 6 month trial" Osteoarthritis. Cartilage 1999, 7 (suppl. A): abstr.144
31. Eugenio-Sarmiento RM., Vanapat DHD., Salido EJ. "The efficacy of chondroitin-sulfate in the treatment of knee osteoarthritis: a meta-analysis" Osteoarthritis. Cartilage, 1999; 7 (suppl.A): abstr. 139
31. Lebb BF., Schweitzer H., Montag K., Smolen JS. "A meta-analysis of chondroitin-sulfate in the treatment of osteoarthritis" J. Rheum., 2000, 27: 205-211
33. Jordan KM., Arden NK., Doherty M. et.al. "EULAR Recommendation 2003: an evidence based approach to the management of knee osteoarthritis: Report of a Task Force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT)." Ann/. Rheum. Dis., 2003, 62: 1145-1155
34. Zhang W., Doherty M., Arden N. et.al. "EULAR evidence based recommendations for the management of hip osteoarthritis: report of task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutic (ESCISIT)." Ann. Rheum. Dis., 2005, 64: 669-681
35. Zhang W., Doherty M., Leeb BF. Et.al. "EULAR evidence based recommendations for the management of hand osteoarthritis: report of task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutic (ESCISIT)." Ann. Rheum. Dis.,2007, 66: 377-388
36. Uebelhart D., Thonar EJMA., Delmas PD. et.al. "Effect of oral chondroitin sulfate on the progression of knee osteoarthritis: a pilot study" J. Rheum., 2001, 28: 49-56
37. Verbruggen G, Goemaere S., Veys EM.,et al. "Systems to assess the progression of finger joint osteoarthritis and the effects of disease modifying osteoarthritis drugs" Clin. Rheum., 2002, 21: 231-43
38. Jordan KM., Arden NK., Doherty M. et.al. "EULAR Recommendation 2003: an evidence based approach to the management of knee osteoarthritis: Report of a Task Force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT)" Ann. Rheum. Dis., 2003, 62: 1145-1155
39. Zhang W., Doherty M., Arden N. et.al. "EULAR evidence based recommendations for the management of hip osteoarthritis: report of task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutic (ESCISIT)" Ann. Rheum. Dis., 2005, 64: 669-681
40. Zhang W., Doherty M., Leeb BF. et.al. "EULAR evidence based recommendations for the management of hand osteoarthritis: report of task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutic (ESCISIT)" Ann. Rheum. Dis.,2007, 66: 377-388
41. McFlinden TE., la Valley MP., Culin JP. et.al. "Glucosamine and Chondroitin for treatment of osteoarthritis. A systematic quality assessment and meta-analysis" JAMA, 200, 283: 1469-1470
42. Reachenbach S., Sterchl R., Scherer M. et.al. "Meta-analysis: Chondroitin for osteoarthritis of the knee and hip" Ann. Int. Med., 2007, 146:580-590
43. Largo R., Sanches-Pernaute O., Moreno-Rubio J., et.al. "Chondroitin sulfate prevents synovial inflammation in an experimental model of chronic arthritis, which might be mediated by the inhibition of the NF-k? dependent pathway" Osteoarthr. Cart., 2008, Vol.16 (supl.4): S28-S29
44. Largo R., Sanches-Pernaute O., Marcos ME., et.al. "Chronic arthritis aggravated vascular lesions in rabbit with atherosclerosis" Arthr. Rheum., V.56: 283-291
45. Cook RW. "Transgenic expression of the human amphiregulin gene induced a psoriasis-like phenotype" J. Clin., Invest., 1997, V.100: 2286-2294
46. Mitsuyama S. "Effects of glycosoaminoglycan polysulfate on extracellular matrix metabolism in human skin cells" Res. Com. Pathol. Pharm., 1994, 83:179-193
47. Brown KW. "Glycoprotein and glycosoaminoglycan of cultured normal epidermal keratinocytes" J. Cells SCI., 1083, V.61: 325-338
48. Volpi N., Chondroitin sulfate for the treatment osteoarthritis? Curr. Med. Chem., 2005, 4: 221-234
49. Moller I., Perez M., Monfort J., et.al. "A randomized, double-blind, placebo-controlled trial on the effects of chondroitin sulphate in patients with knee osteoarthritis and psoriasis" Osteoarthr. Cart., 2008, Vol.16 (supl.4): S232
ИСТОЧНИК РМЖ 2009 Г, ТОМ 17, № 3













